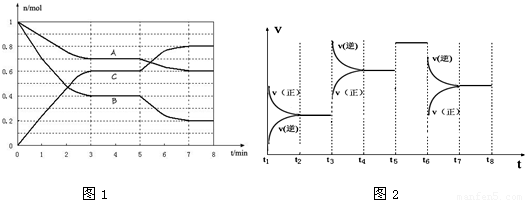
摘要:31.25℃时.在体积为2L的密闭容器中.气态物质A.B.C的物质的量n(mol)随时间t的变化如下图所示.已知达平衡后.降低温度.A的转化率将增大. (1)根据上图数据.写出该反应的化学方程式 ,此反应的平衡常数表达式K= .从反应开始到达第一次平衡时的平均速率v(A)为 . (2) 在5~7min内.若K值不变.则此处曲线变化的原因是 . (3)下图表示此反应的反应速率v和时间t的关系图 各阶段的平衡常数如下表所示: t2 ~ t3 t4 ~ t5 t5 ~ t6 t7 ~ t8 K1 K2 K3 K4 根据上图判断.在t3和t6时刻改变的外界条件分别是 和 ,K1.K2.K3.K4之间的关系为: (用“> .“< 或“= 连接).A的转化率最大的一段时间是 .
网址:http://m.1010jiajiao.com/timu3_id_61287[举报]
25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图1所示.已知达平衡后,降低温度,A的转化率将增大.

(1)从反应开始到达第一次平衡时的平均速率v(A)为
(2)根据上图数据,写出该反应的化学方程式
(3)在5~7min内,若K值不变,则此处曲线变化的原因是
(4)下图2表示此反应的反应速率v和时间t的关系图,根据上图判断,在t3和t5时刻改变的外界条件分别是
查看习题详情和答案>>

(1)从反应开始到达第一次平衡时的平均速率v(A)为
0.05mol/(L?min)
0.05mol/(L?min)
.(2)根据上图数据,写出该反应的化学方程式
A+2B?2C
A+2B?2C
;求出此反应在25℃的平衡常数K=6.43L/mol
6.43L/mol
(保留2位小数).(3)在5~7min内,若K值不变,则此处曲线变化的原因是
增大压强
增大压强
.(4)下图2表示此反应的反应速率v和时间t的关系图,根据上图判断,在t3和t5时刻改变的外界条件分别是
升高温度
升高温度
和加入催化剂
加入催化剂
;A的转化率最大的一段时间是t2~t3
t2~t3
.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如图1所示.已知达平衡后,降低温度,A的转化率将增大.
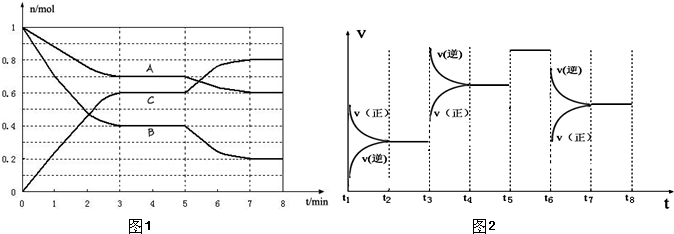
(1)根据图1数据,写出该反应的化学方程式______;此反应的平衡常数表达式K=______.从反应开始到达第一次平衡时的平均速率v(A)为______.
(2)在5~7min内,若K值不变,则此处曲线变化的原因是______.
(3)图2表示此反应的反应速率v和时间t的关系图.
各阶段的平衡常数如下表所示:
根据图2判断,在t3和t6时刻改变的外界条件分别是______和______;K1、K2、K3、K4之间的关系为:______(用“>”、<”或“=”连接).A的转化率最大的一段时间是______.
查看习题详情和答案>>

(1)根据图1数据,写出该反应的化学方程式______;此反应的平衡常数表达式K=______.从反应开始到达第一次平衡时的平均速率v(A)为______.
(2)在5~7min内,若K值不变,则此处曲线变化的原因是______.
(3)图2表示此反应的反应速率v和时间t的关系图.
各阶段的平衡常数如下表所示:
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图所示。已知达平衡后,降低温度,A的转化率将增大。
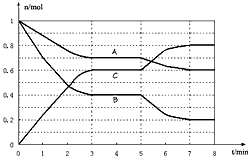
(1)根据上图数据,写出该反应的化学方程式____________________;此反应的平衡常数表达式K=
___________。从反应开始到达第一次平衡时的平均速率v(A)为________________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是______________________________。
(3)下图表示此反应的反应速率v和时间t的关系图
___________。从反应开始到达第一次平衡时的平均速率v(A)为________________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是______________________________。
(3)下图表示此反应的反应速率v和时间t的关系图

各阶段的平衡常数如下表所示
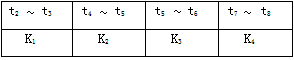
根据上图判断,在t3和t6时刻改变的外界条件分别是_____________和______________;K1、K2、K3、K4之间的关系为:_________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是_________。
查看习题详情和答案>>
25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图所示。 已知达平衡后,降低温度,A的转化率将增大。
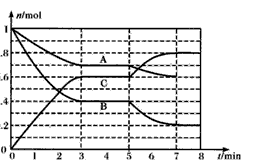
(1)根据上图数据,写出该反应的化学方程式________;此反应的平衡常数表达式K= ___。从反应开始到达第一次平衡时的平均反应速率v(A)为___。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是____。
(3)下图表示此反应的反应速率v和时间t的关系。各阶段的平衡常数如下表所示:
(2)在5~7min内,若K值不变,则此处曲线变化的原因是____。
(3)下图表示此反应的反应速率v和时间t的关系。各阶段的平衡常数如下表所示:
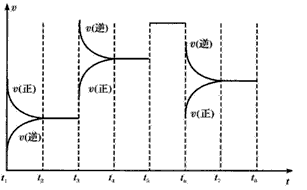

根据上图判断,在t3和t6时刻改变的外界条件分别是____和___;K1、 K2、K3、K4之间的关系为___(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是____。
查看习题详情和答案>>