21、(4分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g) + H2(g) ≒CO(g) + H2O(g),其化学平衡常数K和温度t的关系如下表所示:
|
t/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
⑴该反应的化学平衡常数表达式为K=
⑵该反应为 反应(填“吸热”或“放热”)
⑶能判断该反应达到化学平衡状态的依据是( )
A、容器中压强不变
B、  混合气体中C(CO)不变
混合气体中C(CO)不变
C、 V(H2)正=V(H2O)逆
D、C(CO2)=C(CO)
⑷某温度下,平衡浓度符合下式:C(CO2). C(H2)=C(CO).C(H2O),此时的温度为 ℃
19、(10分)元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分,请依据该表回答问题。
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
|
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
⑴可用作半导体材料的是 元素(填元素符号),它在元素周期表中的位置为第 周期 (族)。
⑵画出第三周期ⅠA族元素的原子结构示意图 ,该元素与同周期ⅧA族元素组成的化合物的电子式是 。以该化合物为主要原料在生产中可支取多种重要的化工产品,请举一例(用化学方程式来说明) 。
 ⑶在第二周期元素的最高价氧化物对应的水化物中,酸性最强的是 (填化学式,下同);具有两性的是
,其与氢氧化物溶液反应的化学方程式为
。
⑶在第二周期元素的最高价氧化物对应的水化物中,酸性最强的是 (填化学式,下同);具有两性的是
,其与氢氧化物溶液反应的化学方程式为
。
14.下述实验不能到达预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟.冷却,再加入银氨溶液,水浴加热 |
检验蔗糖是否已水解 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯气与溴的氧化性强弱 |
|
C |
将铜与浓硝酸反应生成的气体收集后,用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
|
D |
 分别向2支试管中加入相同体积.相同浓度的H2O2溶液,再向其中1支加入少量MnO2 分别向2支试管中加入相同体积.相同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
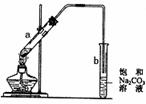 A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,
A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,