8.下列实验操作完全正确的是
|
编号 |
实验内容 |
实验操作 |
|
A |
探究钠与水的反应 |
用镊子从煤油中取出金属钠,切下一小块,小心放 入装满水的烧杯中 |
|
B |
配制5%的氯化钾溶液 100 g |
准确称取 5.0 g氯化钾固体,放入250 mL的烧杯中, 加 100 g蒸馏水,搅拌溶解 |
|
C |
检验NaHCO3样品中是否含有Na2CO3 |
取少量待检样品溶于水,滴加少量BaC12溶液,观 察是否有白色沉淀生成 |
|
D |
取出分液漏斗中的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换 一个接收器,上层液体继续从下端管口放出 |
30.[化学--物质结构与性质](13分)
四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质、结构信息 |
价电子数为5的短周期元素;该元素形成的双原子分子一般情况下很稳定。 |
基态原子的M层有1对成对的p电子。 |
第三周期中第一电离能最小的元素。 |
原子最外电子层上s电子数等于p电子数。 单质为空间网状晶体,具有很高的熔、沸点。 |
(1)写出元素B基态原子的电子排布式 。
C离子的结构示意图 。
(2)元素A形成的气态氢化物的空间构型为 。
(3)A、D两种元素电负性的大小关系为:A D(填“>”、“<”或“=”)。
(4)元素B和C形成的化合物属于 (填“离子”、“原子”或“分子”)晶体。
(5)元素D形成的化合物D2H2属于 (填“极性”或“非极性”)分子。D2H2分子中 个π键,其中σ键的键能 (填“>”、“<”或“=”)π键的键能。
(6)元素B的氢化物熔点比水低,原因是___________________________________________________。
25.(15分)
某工业纯碱中含有少量NaCl和NaOH。学生课外活动小组为测定其中Na2CO3的质量分数,采样进行分析。通过集体讨论,选择下列适当装置连接,对设计方案不断完善,成功地完成了测定实验。
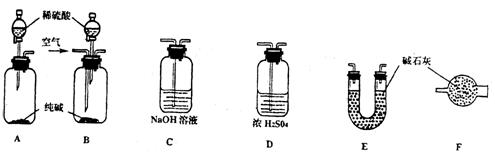
(1)下面是甲、乙、丙、丁、戊五位同学有关设计实验装置的讨论发言。请在空白处填写他们的发言内容:
甲:将装置A和E连接即可。因为Na2CO3与稀硫酸反应生成的CO2被E中的碱石灰吸收,通过分别测量反应前和反应后E的总质量,可求出Na2CO3的质量分数。
乙:还应在A和E之间连接装置__________(填序号),其目的是___________________________。
丙:应该用B装置取代A。从B装置的导管口处缓缓鼓入空气,其目的是___________________
_______________________________________________________________________________________。
丁:由于空气中含有_____________,若直接向B装置鼓入空气会导致实验测定结果__________(填“偏高”、“偏低”或“无影响”)。因此,应将鼓入的空气先通过装置 。
戊:E装置后还应连接装置F,其作用是__________________________________________________。
(2)学生课外活动小组测定的数据如下:
|
工业纯碱样品质量 |
反应前E的总质量 |
反应后E的总质量 |
|
5.5g |
43.9g |
46.1g |
计算该工业纯碱中Na2CO3的质量分数为___________________________。
(3)简述实验室测定上述样品中Na2CO3的质量分数的另一种方法(含实验仪器、实验步骤、实验现象)____________________________________________________________________________________
_______________________________________________________________________________________。
选考部分
第Ⅱ卷选考第30、31题为化学题,考生从两道化学题中各任选一题作答,若第30、31题都作答,则按第30题计分。

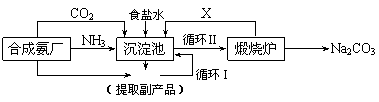

 Ⅱ.某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:
Ⅱ.某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程: (15分)
(15分)