27、(16分)如下图的装置中:
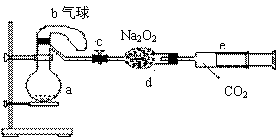 a是盛有标况下的空气(氧气占五分之一
a是盛有标况下的空气(氧气占五分之一
)和10mL 1.2mol/L硝酸的250mL 烧瓶。
b是未充气(实验开始前内部没有气体)
放有0.384g铜粉的气球。c是夹紧了的
弹簧夹。d中盛有足量的过氧化钠。
e是充有二氧化碳的针筒。整套装置已经过气密性检查合格。
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是 。
(2)欲提高铜与硝酸反应的速度可采用多种不同的措施
①若用加入化学试剂法,下列试剂中可以使用的是(填代号) ;
A 蒸馏水 B 无水醋酸钠 C 石墨 D 硝酸银溶液(少量)
②也可用升高温度法,铁圈下方放酒精灯,铁圈上要放___________
③将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是
,
此时气球全在烧瓶外,还是有一部分被吸入烧瓶?____________________________.
④打开弹簧夹将二氧化碳扒推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳 mL
⑤将上述全过程用一个总的化学方程式表示
_______________________________________________________________
28(15分)有机物A能使石蕊试液变红,在浓硫酸作用下可发生如下转化:
|
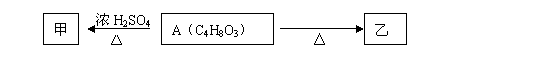

甲、乙分子式均为C4H6O2且都能使溴的四氯化碳溶液褪色。
(1) 甲分子所含官能团的名称是 。A溶液与碳酸氢钠反应的化学方程式为 。
乙能发生的化学反应有(填序号) a.酯化反应 b.氧化反应 c.水解反应
(2) B是A的同系物,相对分子质量小于A。B与浓硫酸作用得到的产物在一定条件下可发生加聚反应,该加聚反应的化学方程式为 。
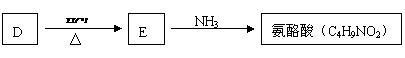 (3) A的一种同分异构体D(结构中无甲基)是化学法生产氨酪酸的原料。氨酪酸属于氨基酸,有降低人体血氨和促进脑代谢的作用。D、E及氨酪酸之间有如图所示的转化关系。(提示:
(3) A的一种同分异构体D(结构中无甲基)是化学法生产氨酪酸的原料。氨酪酸属于氨基酸,有降低人体血氨和促进脑代谢的作用。D、E及氨酪酸之间有如图所示的转化关系。(提示: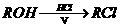 )
)
氨酪酸的结构简式为 。
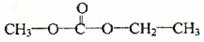
(4) A的另一种同分异构体简称EMC,用于制造可充电电池。EMC在氢氧化钠溶液中水解可得到三种含碳化合物。EMC的结构简式为 。
29 (14分)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:


①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明) 。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
(3)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH
NH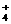 +NH
+NH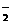 ,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是 ;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是 ;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
6 b7 c 8 a 9 d 10 c 11 a 12 d 13 d
26 (15分)(其他合理答案参照本标准给分)
|
|
 (1)N≡N (2分)
(1)N≡N (2分)
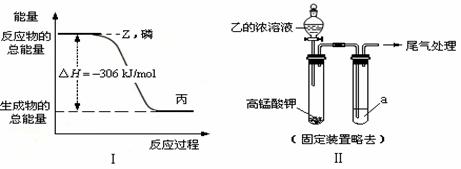
(2) ∶Cl∶P∶Cl∶ P(s)+3/2Cl2(g)=PCl3(l);△H= –306 kJ/mol
|
|
|
|
(4)Cl2、NH3
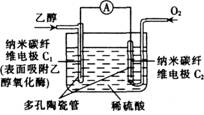 A.C1极为电池负极,C2极为电池正极
A.C1极为电池负极,C2极为电池正极 2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述不正确的是
2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述不正确的是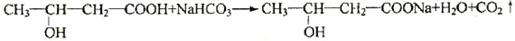 (2分)
(2分) (2)
(2分)
(2)
(2分)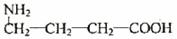
 Cu+2N2O4=Cu(NO3)2+2NO↑
Cu+2N2O4=Cu(NO3)2+2NO↑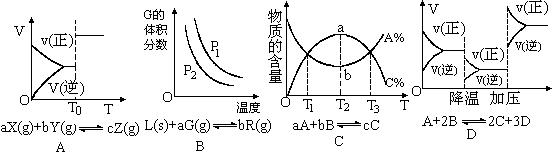


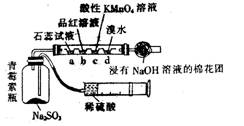 如图装置是用药穴板设计成的SO2气体多性质反应器,可制取SO2并探究其水溶性、漂白性、还原性等。下列有关叙述中不正确的是( )
如图装置是用药穴板设计成的SO2气体多性质反应器,可制取SO2并探究其水溶性、漂白性、还原性等。下列有关叙述中不正确的是( )
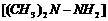 ,氧化剂是四氧化二氮,发生的反应可写成:
,氧化剂是四氧化二氮,发生的反应可写成:
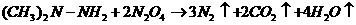
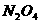
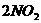
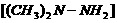 与
与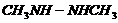 的沸点不同
的沸点不同
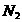 ,转移电子的物质的量为
,转移电子的物质的量为