摘要:24. Ⅰ.我国化学家侯德榜改革国外的纯碱生产工艺.生产流程可简要表示如下: (1)使原料氯化钠的利用率从70%提高到90%以上.主要涉及了 的循环.从沉淀池中取出沉淀的操作是 . (2)为检验产品碳酸钠中是否含有氯化钠.可取少量试样溶于水后.再滴加 . 中通氨气.加入细小食盐颗粒.冷却析出副产品.通氨气的作用有 . A.增大NH4+的浓度.使NH4Cl更多地析出 B.使NaHCO3更多地析出 C.使NaHCO3转化为Na2CO3.提高析出的NH4Cl纯度 Ⅱ.某化工厂为了综合利用生产过程中的副产品CaSO4.与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程: 试填空. (1)沉淀池中发生主要反应的化学方程式为 . 该反应能够发生的原因是 . (2)该生产过程中可以循环使用的物质X是 . (3)上述生产流程中.有关NH3的作用及说明正确的是 . A.提供制备所需的氮元素 B.增大CO32-的浓度促进反应发生 C.作反应的催化剂 D.生产1 mol (NH4)2SO4.至少消耗2 mol NH3
网址:http://m.1010jiajiao.com/timu3_id_56353[举报]
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
①上述生产纯碱的方法称
②沉淀池中发生的化学反应方程式是
③写出上述流程中X物质的分子式
④向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
A.增大NH4+的浓度,使NH4Cl更多地析出 B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
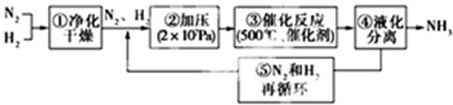
⑥下列是哈伯法合成氨的流程图,其中为提高原料转化率而采取的措施有
查看习题详情和答案>>

①上述生产纯碱的方法称
联合制碱法或侯德榜制碱法
联合制碱法或侯德榜制碱法
,②沉淀池中发生的化学反应方程式是
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓
.③写出上述流程中X物质的分子式
CO2
CO2
.④向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
AC
AC
.A.增大NH4+的浓度,使NH4Cl更多地析出 B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
⑥下列是哈伯法合成氨的流程图,其中为提高原料转化率而采取的措施有
②④⑤
②④⑤
.
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1)上述生产纯碱的方法称
(2)沉淀池中发生的化学反应方程式是
(3)写出上述流程中X物质的分子式
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
查看习题详情和答案>>

(1)上述生产纯碱的方法称
联合制碱法
联合制碱法
,副产品的一种用途为做化肥
做化肥
.(2)沉淀池中发生的化学反应方程式是
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓
.(3)写出上述流程中X物质的分子式
CO2
CO2
.(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了
Ⅰ
Ⅰ
(填上述流程中的编号)的循环.从沉淀池中取出沉淀的操作是过滤
过滤
.(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
用硝酸酸化的硝酸银,观察产生白色沉淀;
用硝酸酸化的硝酸银,观察产生白色沉淀;
.我国化学家侯德榜(图1)改革国外的纯碱生产工艺,生产流程可简要表示如图2: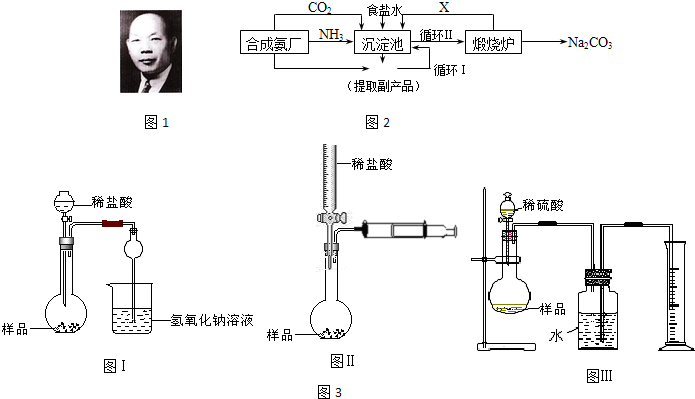
(1)写出上述流程中X物质的分子式
(2)使原料氯化钠的利用率从70%提高到90%以上,主要涉及了
(3)该实验得到的纯碱中含有氯化钠,甲同学设计如图3装置Ⅰ,拟通过测定烧杯中氢氧化钠溶液的增重来测定样品中碳酸钠的含量,但该实验存在明显不足,试举出该装置引起误差的两个主要原因:
①
②
(4)乙同学设计的测定样品中纯碱含量的方法如图3Ⅱ,试回答:
①检查该装置气密性的方法为:
②设滴定管的起始读数为V1mL,终了读数为V2mL,注射器收集的气体为V3mL(标准状况),称得样品质量为m g,则原样品中碳酸钠的质量分数的表达式为
(5)丙同学设计的测定样品中纯碱含量的方法如图3Ⅲ,并在广口瓶中的水上面滴加少量植物油,试回答:
①你认为植物油的作用是
②为减小误差,读取量筒中水的体积时的注意事项有:
查看习题详情和答案>>

(1)写出上述流程中X物质的分子式
CO2
CO2
,沉淀池中发生的化学反应方程式是NH3+H2O+CO2+NaCl→NH4Cl+NaHCO3↓
NH3+H2O+CO2+NaCl→NH4Cl+NaHCO3↓
.(2)使原料氯化钠的利用率从70%提高到90%以上,主要涉及了
循环Ⅰ
循环Ⅰ
(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是过滤
过滤
.(3)该实验得到的纯碱中含有氯化钠,甲同学设计如图3装置Ⅰ,拟通过测定烧杯中氢氧化钠溶液的增重来测定样品中碳酸钠的含量,但该实验存在明显不足,试举出该装置引起误差的两个主要原因:
①
稀盐酸挥发出的氯化氢气体也被氢氧化钠溶液吸收
稀盐酸挥发出的氯化氢气体也被氢氧化钠溶液吸收
.②
烧瓶和导管中滞留的二氧化碳气体不能被氢氧化钠溶液吸收
烧瓶和导管中滞留的二氧化碳气体不能被氢氧化钠溶液吸收
. (4)乙同学设计的测定样品中纯碱含量的方法如图3Ⅱ,试回答:
①检查该装置气密性的方法为:
关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,松手后回到原来位置,说明气密性良好
关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,松手后回到原来位置,说明气密性良好
.②设滴定管的起始读数为V1mL,终了读数为V2mL,注射器收集的气体为V3mL(标准状况),称得样品质量为m g,则原样品中碳酸钠的质量分数的表达式为
106×
×100%
| V3-(V2-V1) |
| 22400m |
106×
×100%
(用含V1、V2、V3、m的代数式表示)| V3-(V2-V1) |
| 22400m |
(5)丙同学设计的测定样品中纯碱含量的方法如图3Ⅲ,并在广口瓶中的水上面滴加少量植物油,试回答:
①你认为植物油的作用是
减少二氧化碳在水中的溶解,减小实验误差
减少二氧化碳在水中的溶解,减小实验误差
.②为减小误差,读取量筒中水的体积时的注意事项有:
读数前上下移动量筒使广口瓶内液面与量筒内液面相平;读取量筒中水的体积时要平视
读数前上下移动量筒使广口瓶内液面与量筒内液面相平;读取量筒中水的体积时要平视
.索尔维制碱法距今已有140多年的历史,为当时世界各国所采用,后被中国的侯氏制碱法取代.索尔维法的生产流程如下所示:
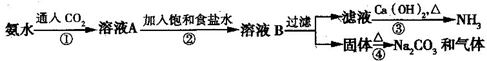
索尔维法能实现连续生产,但食盐的利用率只有70%,且副产品CaCl2没有合适的用途,会污染环境.
1940年我国化学家侯德榜先生经过多次试验,弥补了索尔维法的技术缺陷,加以改进,食盐利用率高达96%,得到了纯碱和氯化铵两种产品,被称为“侯氏制碱法”.此方法的基本原理如下:
①向30~50℃的饱和食盐水中,先通入氨气至饱和,再通入CO2,从而得到碳酸氢钠沉淀.
②过滤,将滤渣加热而得产品.
③向滤液中加入细食盐末,调节温度为10~15℃,使NH4Cl沉淀,过滤,滤渣为NH4Cl产品,滤液为饱和食盐水.
请回答下列问题:
(1)写出向含氨气的饱和NaCl溶液中通入CO2 时发生反应的两个化学方程式:
(2)不能向饱和NaCl溶液中通入CO2 制NaHCO3的原因是
(3)写出在索尔维法生产过程中,生成CaCl2 的化学反应方程式为
(4)在侯氏制碱法中,
(5)侯氏制碱法与索尔维法相比,其优点是
查看习题详情和答案>>

索尔维法能实现连续生产,但食盐的利用率只有70%,且副产品CaCl2没有合适的用途,会污染环境.
1940年我国化学家侯德榜先生经过多次试验,弥补了索尔维法的技术缺陷,加以改进,食盐利用率高达96%,得到了纯碱和氯化铵两种产品,被称为“侯氏制碱法”.此方法的基本原理如下:
①向30~50℃的饱和食盐水中,先通入氨气至饱和,再通入CO2,从而得到碳酸氢钠沉淀.
②过滤,将滤渣加热而得产品.
③向滤液中加入细食盐末,调节温度为10~15℃,使NH4Cl沉淀,过滤,滤渣为NH4Cl产品,滤液为饱和食盐水.
请回答下列问题:
(1)写出向含氨气的饱和NaCl溶液中通入CO2 时发生反应的两个化学方程式:
CO2+NH3+H2O=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl
CO2+NH3+H2O=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl
.(2)不能向饱和NaCl溶液中通入CO2 制NaHCO3的原因是
H2CO3酸性比盐酸弱,CO2与NaCl不反应
H2CO3酸性比盐酸弱,CO2与NaCl不反应
;也不能采用先向饱和NaCl溶液中通入CO2,再通入NH3的方法制NaHC03 的原因是CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶析出
CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶析出
.(3)写出在索尔维法生产过程中,生成CaCl2 的化学反应方程式为
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
.(4)在侯氏制碱法中,
二氧化碳和饱和食盐水
二氧化碳和饱和食盐水
(填物质名称)可以循环利用.(5)侯氏制碱法与索尔维法相比,其优点是
使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用
使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用
(任写一条即可).(2011?青岛模拟)【化学-化学与技术】
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1)沉淀池中发生的化学反应方程式是
(2)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了
(3)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度.
查看习题详情和答案>>
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)沉淀池中发生的化学反应方程式是
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓
,上述生产纯碱的方法中副产品的一种用途为化肥(焊药或电解液)
化肥(焊药或电解液)
;(2)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了
Ⅰ
Ⅰ
(填上述流程中的编号)的循环.从沉淀池中取出沉淀的操作是过滤
过滤
;(3)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
AC
AC
.A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度.