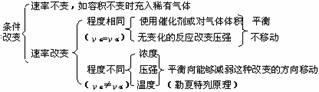
2.平衡移动原理(勒夏特列原理)
如果改变影响平衡的一个条件(如浓度、压强或温度),平衡就向能够减弱这种改变的方向移动。
注意:(1)减弱即为削弱,不可能完全抵消。
(2)催化剂对化学平衡状态无影响。
27.(10分)
下面是某些短周期元素电负性大小的值(以X表示):
|
元素 |
Li |
Be |
B |
C |
O |
F |
|
X 值 |
1.0 |
1.5 |
2.0 |
2.5 |
3.5 |
4.0 |
|
元素 |
Na |
Al |
Si |
P |
S |
Cl |
|
X 值 |
0.9 |
1.5 |
1.8 |
2.1 |
2.5 |
3.0 |
(1)推测X值与原子半径的关系是 ;
根据短周期元素的X值变化特点,体现了元素性质的 变化规律。
(2)由上述规律可以判断N元素的电负性大小范围是 <X(N)< 。
(3) CH3CHO分子中,-CH3中的碳原子采用 杂化方式,-CHO中的碳原子采取 杂化方式。
(4)O、S两种元素的氢化物都属于___________(填写晶体类型),试判断两种氢化物的沸点高低顺序并解释原因:_________________________________________________。
(5)2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子
 能谱证实:洁净铁(可用于合成氨反应的催化剂)的
能谱证实:洁净铁(可用于合成氨反应的催化剂)的
表面上存在氮原子,右图为氮原子在铁的晶面上的单
层附着局部示意图(图中小黑色球代表氮原子,灰色
球代表铁原子)。则在图示状况下,铁表面上
N/Fe原子数比值为 。
24.(12分)
减少SO2的排放、回收利用SO2是环保的重要课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
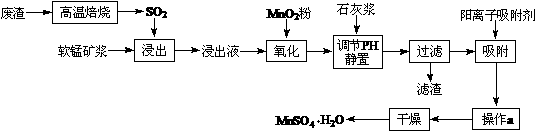
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其它金属离子。
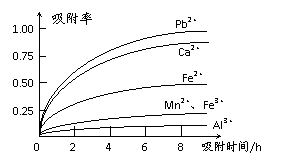
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子
的效果见下图。
|
离子 |
离子半径(pm) |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
74 |
7.6 |
9.7 |
|
Fe3+ |
64 |
2.7 |
3.7 |
|
Al3+ |
50 |
3.8 |
4.7 |
|
Mn2+ |
80 |
8.3 |
9.8 |
|
Pb2+ |
121 |
8.0 |
8.8 |
|
Ca2+ |
99 |
- |
- |
已知PbO2的氧化性强于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式 ,
氧化过程中主要反应的离子方程式 。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至范围 ,
滤渣的主要成分有 。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是
(填写序号)。
a.溶液的pH b.金属离子的氧化性 c.金属离子的半径 d.吸附时间
⑷ 操作a包括 过程。
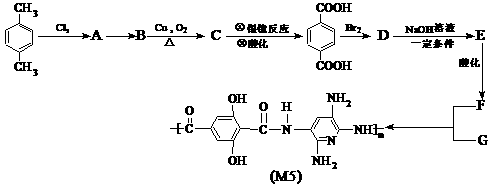
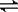 2Z(g)此反应达到平衡的标志是(
)
2Z(g)此反应达到平衡的标志是(
)

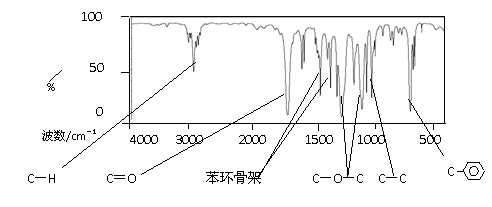

 ① 写出D
E的化学方程式
。
① 写出D
E的化学方程式
。