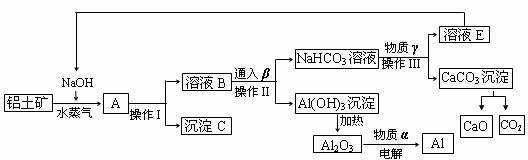
22.(12分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀。
试回答下列问题:
(1) 写出化学式:A___________ B___________ D_________
(2) E溶液呈酸性的原因是:(用离子方程式表示)_______________________________
(3 ) 将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(4 )在100mL0.1mol·L-1 E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 mol
16.为了研究在温度对苯催化加氢的影响,以检验新型镍催化剂的性能。其他条件相同,定时取
样分析成分:
|
温度/℃ |
85 |
90 |
95 |
100 |
110-240 |
280 |
300 |
320 |
340 |
|
苯 |
96.05 |
91.30 |
91.55 |
80.85 |
0 |
23.35 |
36.90 |
55.99 |
72.37 |
|
环己烷 |
3.95 |
8.7 |
8.45 |
19.15 |
100 |
76.65 |
63.10 |
44.01 |
27.63 |
(采用微型反应装置,压强为0.78MPa,氢苯摩尔比为6. 5∶1)
下列说法错误的是
A.随着反应温度的升高,苯的转化率先升高后降低
B.在110~240℃苯的转化率为100%。说明该镍催化剂活性较高,能够在较宽的温度范围内催化
而且不发生副反应
C.压强与氢苯摩尔比的增大都有利于提高苯的转化率
D.当温度超过280℃,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应
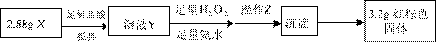
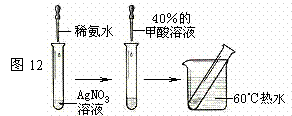 猜想II:甲酸能发生银镜反应;
猜想II:甲酸能发生银镜反应;
 实验方案请参考如下形式:
实验方案请参考如下形式: 溶液生产NaOH和H2SO4 ,下列说法中正确的是
溶液生产NaOH和H2SO4 ,下列说法中正确的是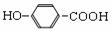 D. 尼泊金酸(
)与碳酸氢钠溶液反应:
D. 尼泊金酸(
)与碳酸氢钠溶液反应:
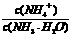 增大
增大