摘要:4.“等效平衡 原理及规律 (1)等效平衡原理 相同条件下.同一可逆反应体系.不管从正反应开始.还是从逆反应开始.只要按反应方程式中的化学计量数之比投入反应物或生成物.建立起的平衡状态都是相同的. (2)等效平衡规律 ① 在定温.定容条件下.对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量.如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同.则两平衡等效. ② 定温.定容情况下.对于反应前后气体分子数不改变的可逆反应.只要反应物的物质的量的比值与原平衡相同.两平衡等效. ③ 在定温.定压下.改变起始时加入物质的物质的量.只要按化学计量数换算成同一半边的物质的物质的量.若比值与原平衡相同.则达平衡后与原平衡等效.
网址:http://m.1010jiajiao.com/timu3_id_56048[举报]
可持续发展是全球经济发展的共同课题,珍惜地球,保护环境已成为我国的基本国策.汽车尾气(含烃类,CO,SO2,NO等物质)是城市空气的污染源.治理方法之一是在汽车排气管上装一个“催化转换器”(用铂、钯合金作催化剂),它的特点是使CO与NO反应,生成两种可参与大气生态循环的无毒气体,并促使烃类充分燃烧及SO2催化氧化.
(1)写出CO与NO在催化剂作用下的反应方程式:________
(2)“催化剂转换器”的缺点是在一定程度上提高了空气的酸度,其原因是________
(3)控制城市空气污染源的方法可行的有
[ ]
A.开发氢能源
B.使用电动车
C.植树造林
D.戴上呼吸面具
(4)汽车尾气经“催化转换器”处理后的大量气体使地球的温室效应增强,下列叙述中不正确的是
[ ]
A.如果没有地球的自然温室效应,大多数的生命都将不存在
B.全球工业发展造成温室效应的增加,导致全球变暖
C.限制发展中国家的工业气体排放,可以使大气中温室气体浓度趋于稳定水平
D.森林大幅度地吸收二氧化碳,可缓解全球温室效应的危机
(5)现代科学技术的迅速发展和广泛应用,带来了经济增长,却使全球面临资源枯竭、环境污染、生态污染和生态失衡等一系列危机,这说明
[ ]
A.任何事物都是一分为二的
B.科学技术的发展是产生危机的根源
C.旧的矛盾解决了,又会产生新的矛盾
D.规律是客观的,违背规律是要遭到惩罚的
查看习题详情和答案>>
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
C+ K2Cr2O7+ → CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式.
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①下列措施中有利于增大该反应的反应速率的是 ;
A、随时将CH3OH与反应混合物分离
B、降低反应温度
C、增大体系压强
D、使用高效催化剂
②已知:CO(g)+
O2(g)=CO2(g)△H2=-283 kJ?mol-1H2(g)+
O2(g)=H2O(g)△H3=-242 kJ?mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;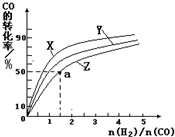
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是 ;
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g) 的平衡常数K= .
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 .
查看习题详情和答案>>
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
请完成并配平上述化学方程式.
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①下列措施中有利于增大该反应的反应速率的是
A、随时将CH3OH与反应混合物分离
B、降低反应温度
C、增大体系压强
D、使用高效催化剂
②已知:CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为

③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g) 的平衡常数K=
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运 用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
____C + ____K2Cr2O7 + ____→ ____CO2↑+ ____K2SO4 + ____Cr2(SO4)3 + ____H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ/mol
CH3OH(g) △H1=-116 kJ/mol
①下列措施中有利于增大该反应的反应速率的是 _______;
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
②已知:
 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________;
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
请回答:
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
____C + ____K2Cr2O7 + ____→ ____CO2↑+ ____K2SO4 + ____Cr2(SO4)3 + ____H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g)
 CH3OH(g) △H1=-116 kJ/mol
CH3OH(g) △H1=-116 kJ/mol①下列措施中有利于增大该反应的反应速率的是 _______;
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
②已知:
 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1  △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1 则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________;
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
请回答:

ⅰ)在上述三种温度中,曲线Z对应的温度是___________________;
ⅱ)利用图中a点对应的数据,计算出曲线Z 在对应温度下CO(g)+ 2H2(g) CH3OH(g) 的平衡常数K =__________。
CH3OH(g) 的平衡常数K =__________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为__________。
查看习题详情和答案>>
ⅱ)利用图中a点对应的数据,计算出曲线Z 在对应温度下CO(g)+ 2H2(g)
 CH3OH(g) 的平衡常数K =__________。
CH3OH(g) 的平衡常数K =__________。(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为__________。
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运 用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
____C + ____K2Cr2O7 + ____→ ____CO2↑+ ____K2SO4 + ____Cr2(SO4)3 + ____H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ/mol
CH3OH(g) △H1=-116 kJ/mol
①下列措施中有利于增大该反应的反应速率的是 _______;
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
②已知:
 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________;
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
请回答:
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
____C + ____K2Cr2O7 + ____→ ____CO2↑+ ____K2SO4 + ____Cr2(SO4)3 + ____H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g)
 CH3OH(g) △H1=-116 kJ/mol
CH3OH(g) △H1=-116 kJ/mol①下列措施中有利于增大该反应的反应速率的是 _______;
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
②已知:
 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1  △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1 则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________;
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
请回答:

ⅰ)在上述三种温度中,曲线Z对应的温度是___________________;
ⅱ)利用图中a点对应的数据,计算出曲线Z 在对应温度下CO(g)+ 2H2(g) CH3OH(g) 的平衡常数K =__________。
CH3OH(g) 的平衡常数K =__________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为__________。
查看习题详情和答案>>
ⅱ)利用图中a点对应的数据,计算出曲线Z 在对应温度下CO(g)+ 2H2(g)
 CH3OH(g) 的平衡常数K =__________。
CH3OH(g) 的平衡常数K =__________。(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为__________。

请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是____________。
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下 CO(g)+2H2(g) CH3OH(g)的平衡常数K =___________ 。
CH3OH(g)的平衡常数K =___________ 。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为___________。
查看习题详情和答案>>
ⅰ)在上述三种温度中,曲线Z对应的温度是____________。
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下 CO(g)+2H2(g)
 CH3OH(g)的平衡常数K =___________ 。
CH3OH(g)的平衡常数K =___________ 。(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为___________。
 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1  △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1  △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1