9.当前,一次性筷子、一次性饭盒的安全也受到社会的关注。专家介绍说,正规的一次性筷子所用的原料都是质地较好的木材,不用特殊加工。但是很多小作坊为了降低成本,使用劣质木材,为筷子看上去白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会对人体造成铅中毒或汞中毒。
(1)“硫磺熏蒸”是应用二氧化硫的漂白性质,写出硫磺燃烧的化学方式
___________________________________________
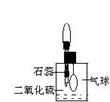 (2)防止、减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量。为研究SO2的溶解性质,某学生做如下实验:如右图,集气瓶中收集的是SO2,瓶塞系着瘪气球,向瓶中滴加紫色石蕊试液,实验现象是________。为比较SO2 和CO2溶解性的大小,某学生采取同样的装置和操作,能说明SO2在水中的溶解性大于CO2在水中溶解性的实验现象是____________。某学生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为_______,接着向溶液中加入足量氯水,实验现象为_______,再滴加BaCl2溶液,实验现象为_____________。
(2)防止、减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量。为研究SO2的溶解性质,某学生做如下实验:如右图,集气瓶中收集的是SO2,瓶塞系着瘪气球,向瓶中滴加紫色石蕊试液,实验现象是________。为比较SO2 和CO2溶解性的大小,某学生采取同样的装置和操作,能说明SO2在水中的溶解性大于CO2在水中溶解性的实验现象是____________。某学生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为_______,接着向溶液中加入足量氯水,实验现象为_______,再滴加BaCl2溶液,实验现象为_____________。
(3)在制一次性筷子时有“抛光”程序:加入滑石粉和木签一起搅拌,起到干燥、打磨的作用,使筷子变得光滑,以免毛疵划人的口腔。已知滑石粉是一种含水的具有层状结构的硅酸盐矿物。其质量组成为MgO 31.88%,SiO2 63.37%,H2O 4.75%,其化学式为 。
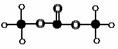
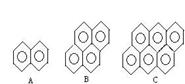 (4)有的厂家用石蜡代替“滑石粉抛光”,石蜡是含碳原子数(C20-C30)较多的稠环芳香烃,常温下为固体,温度高时熔化后可随食物进入人体致使慢性中毒。有如右的一系列物质,则A的分子式为 ,A、B、C 可以互称同系物吗?为什么?_____________?该系列化合物里碳的最大质量分数为
? 若E是A的一个氢原子被羟基取代的产物,预测E可能具有哪些化学性质(至少举2条)
(4)有的厂家用石蜡代替“滑石粉抛光”,石蜡是含碳原子数(C20-C30)较多的稠环芳香烃,常温下为固体,温度高时熔化后可随食物进入人体致使慢性中毒。有如右的一系列物质,则A的分子式为 ,A、B、C 可以互称同系物吗?为什么?_____________?该系列化合物里碳的最大质量分数为
? 若E是A的一个氢原子被羟基取代的产物,预测E可能具有哪些化学性质(至少举2条)
|
答案:(1)S+O2=SO2
(2)紫色石蕊试液变红、气球鼓胀起来 SO2溶解时气球鼓胀的程度大于CO2溶解时气球的鼓胀程度 品红溶液的红色褪去(品红、SO2结合成不稳定的化合物),溶液显浅紫色(石蕊的颜色) 先变红后褪色(足量氯水能氧化SO2、石蕊和品红试液) 生成白色沉淀(BaSO4)。
(3)Mg3(Si4O10)(OH)2
(4)C10H8 。不能,因为A、B、C 相差n个C6H2,不是n个CH2。解析:(4)因该系列化合物的通式为C6n+4H2n+6(n≥1),用数学极限思想求得C﹪的最大值为 97.3﹪。根据题意知E是C10H7-OH,应具有与苯酚相似的化学性质,可推测E能与溴水发生取代反应、E与FeCl3能发生显色反应、 E能和碳酸钠溶液反应等。
7.中央电视台新闻栏目2006年5月14日报道齐齐哈尔第二制药有限公司生产的假药事件, “齐二药”违反规定,购入工业用“二甘醇”代替医用丙二醇(C3H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇,造成多名患者死亡。二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,其主要产品有吗啉及其衍生物1,4-二恶烷(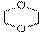 )等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛。二甘醇一般的合成路线为:
)等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛。二甘醇一般的合成路线为:



|
① ② ③ ④
请回答下列问题:
(1)下列关于“丙二醇”和“二甘醇”及“乙二醇”的有关说法正确的是
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程Ⅰ是石油加工中常用步骤,其名称为 。
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,则为了能得到二甘醇D,物质B到物质C的反应条件是 ,该反应属于 (添反应类型)。写出B可能生成E的化学方程式: 。
(4)物质D是二甘醇,则合成路线中的物质A、B、C的结构简式分别是:
A: B: C:
(5)反应Ⅲ的化学方程式为: 。
(6) 写出二甘醇制备1,4-二恶烷的化学方程式: 。
答案:(1)A (2)裂解;(3)NaOH水溶液,取代反应;

CH2BrCH2Br + 2NaOH HC≡CH↑+ 2 NaBr (3分)
(4) A:CH2=CH2,B:Br-CH2-CH2-Br,C:HO-CH2-CH2-OH。(各1分共3分)
(5)2HO-CH2-CH2-OH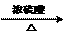 2HO-CH2-CH2-O-CH2-CH2-OH+H2O(3分)
2HO-CH2-CH2-O-CH2-CH2-OH+H2O(3分)
(6)HO-CH2-CH2-O-CH2-CH2-OH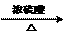
 +H2O (3分)
+H2O (3分)
解析:本题涉及到石油的裂解、有机反应类型、有机反应条件的选择等方面的知识。从产物可以看出本题的物质的转化关系,从而容易得到有机物的结构简式。D是HO-CH2-CH2-O-CH2-CH2-OH,C为HO-CH2-CH2-OH,B为Br-CH2-CH2-Br,A为CH2=CH2。知道了具体的物质其他问题就可以解决。

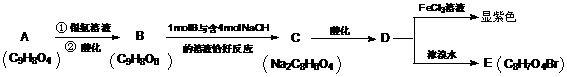
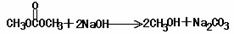 D → E:
D → E:
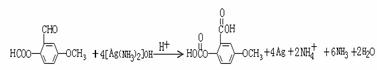
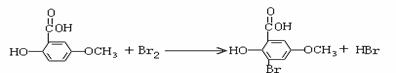 氧化反应
氧化反应 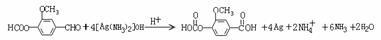 或者:
或者:

 (2)Fe2O3
+3CO
(2)Fe2O3
+3CO 2Fe
+ 3CO2
2Fe
+ 3CO2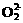 和
和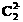 ,可知丙为
,可知丙为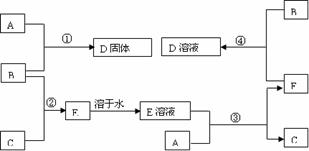

 (2)紫黑色
(3)
(2)紫黑色
(3)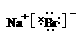
 4HF+O2(5)He (6)NaOH HBrO4 HF
4HF+O2(5)He (6)NaOH HBrO4 HF