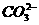3.例题精讲
[例1].四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃,拟利用图中的仪器,设计组装一套实验装置,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。请回答下列各问题。
 (1)用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)________接________、________接________、________
(1)用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)________接________、________接________、________
接________、________接________、________接________。 (2)装置Ⅵ的作用是___________;装置Ⅳ的作用是_____________。 (3)冷凝管理冷却水的流向是从__________进入,从__________流出。 (4)实验时应先点燃_____________处酒精灯,加热温度应大于______________℃,待__________即可停止加热。 (5)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为 。
(6)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是____________。
(7)为了防止污染空气,在装置的最后应____________。
[解析]:这是一个制备实验。
实验目的是:制备无水SnCl4
实验原理是:Sn+2Cl2  SnCl4
先制备Cl2:2H2SO4(浓)+2NaCl+MnO2
SnCl4
先制备Cl2:2H2SO4(浓)+2NaCl+MnO2  Na2SO4+MnSO4+Cl2↑+2H2O
实验的干扰因素是:SnCl4遇水强烈水解,因此,除去实验中水蒸气的干扰,是实验成败的关键。这里要分析水蒸气的来源以及除去水蒸气的措施。水蒸气的来自于制Cl2和空气中的水蒸气。
题目中提供的信息:SnCl4的性质在设计方案时要充分利用这些信息。
以上问题清楚了,实验方案就基本确定了。
答案:
(1)B接J,I接K,A接C,D接G,H接E(或F)
(2)除去Cl2中混有的HCl和水蒸气,在制Cl2时发生的副反应2NaCl+H2SO4
Na2SO4+MnSO4+Cl2↑+2H2O
实验的干扰因素是:SnCl4遇水强烈水解,因此,除去实验中水蒸气的干扰,是实验成败的关键。这里要分析水蒸气的来源以及除去水蒸气的措施。水蒸气的来自于制Cl2和空气中的水蒸气。
题目中提供的信息:SnCl4的性质在设计方案时要充分利用这些信息。
以上问题清楚了,实验方案就基本确定了。
答案:
(1)B接J,I接K,A接C,D接G,H接E(或F)
(2)除去Cl2中混有的HCl和水蒸气,在制Cl2时发生的副反应2NaCl+H2SO4  2HCl↑+Na2SO4,产生了HCl;防止空气中的水蒸气进入锥形瓶中使SnCl4发生水解。
(3)a、p (4)I 231℃
Sn粒熔化
(5)SnCl4+2H2O=SnO2+4HCl
(6)出现白色烟雾
(7)通入NaOH溶液中,吸收多余Cl2
2HCl↑+Na2SO4,产生了HCl;防止空气中的水蒸气进入锥形瓶中使SnCl4发生水解。
(3)a、p (4)I 231℃
Sn粒熔化
(5)SnCl4+2H2O=SnO2+4HCl
(6)出现白色烟雾
(7)通入NaOH溶液中,吸收多余Cl2
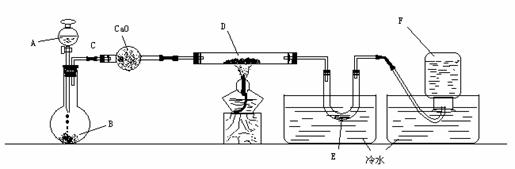
[例2].为了测定工业纯碱中碳酸钠的质量分数(纯碱中常含少量NaCl),某学生设计了实验装置如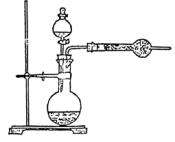 图
(1)准确称取盛有碱石灰的干燥管的质量(设为W1)
(2)准确称取一定量纯碱样品(设为W0),并放入烧瓶中。从分液漏斗缓缓滴入稀硫酸,待不再发生气体后。称干燥管的总质量(设为W2)。设学生导出的计算公式为:
Na2CO3的质量分数=
图
(1)准确称取盛有碱石灰的干燥管的质量(设为W1)
(2)准确称取一定量纯碱样品(设为W0),并放入烧瓶中。从分液漏斗缓缓滴入稀硫酸,待不再发生气体后。称干燥管的总质量(设为W2)。设学生导出的计算公式为:
Na2CO3的质量分数= 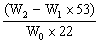 ×100%
试回答:
①W2-W1表示什么?
②如果不计称量误差,该生的实验结果有无明显误差?如有,是偏大还是偏小?请简要说明根据并提出补救措施。
[解析]:这是一道定量实验题
实验目的是:测定纯碱中 Na2CO3的质量分析
实验原理:稀H2SO4与Na2CO3反应生成Cl2,测出CO2的质量即可求出Na2CO3的质量,继而求出Na2CO3的质量分数。
CO2的质量为(W2-W1)g,样品质量为W0g
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x W2-W1
×100%
试回答:
①W2-W1表示什么?
②如果不计称量误差,该生的实验结果有无明显误差?如有,是偏大还是偏小?请简要说明根据并提出补救措施。
[解析]:这是一道定量实验题
实验目的是:测定纯碱中 Na2CO3的质量分析
实验原理:稀H2SO4与Na2CO3反应生成Cl2,测出CO2的质量即可求出Na2CO3的质量,继而求出Na2CO3的质量分数。
CO2的质量为(W2-W1)g,样品质量为W0g
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x W2-W1
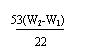
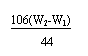
x= =

Na2CO3%= ×100%
产生误差的原因(即干扰因素)有烧瓶的CO2不能都被碱石灰吸收,实验值偏低。CO2气体混有的水蒸气和空气中的水蒸气被碱石灰吸收,使实验值偏高,两个因素综合考虑,CO2的影响是主要的,所以 实验值偏低。
补救的办法:如图
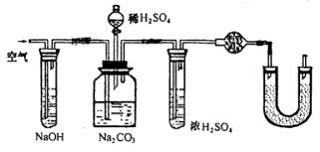 ①将蒸馏烧瓶改为集气瓶,利于排出CO2。
②向集气瓶中通入(已除去CO2)空气,用空气将烧瓶中Cl2尽量排出去。
③在干燥管前连接盛有浓H2SO4的试管,以除去水蒸气;
④在U型管中装有碱石灰,以吸收空气中的CO2气体,经过这些补救措施,实验误差可以降低。
[例3].实验室中用浓盐酸与MnO2制Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉,已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O,现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
①将蒸馏烧瓶改为集气瓶,利于排出CO2。
②向集气瓶中通入(已除去CO2)空气,用空气将烧瓶中Cl2尽量排出去。
③在干燥管前连接盛有浓H2SO4的试管,以除去水蒸气;
④在U型管中装有碱石灰,以吸收空气中的CO2气体,经过这些补救措施,实验误差可以降低。
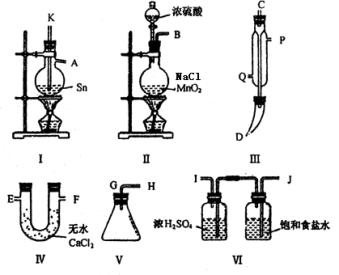
[例3].实验室中用浓盐酸与MnO2制Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉,已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O,现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
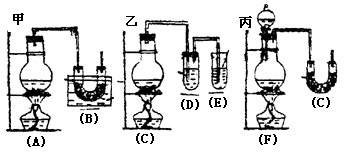
(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内(错选、漏选、多选均倒扣分) a.不易控制反应速率 b.容易控制反应速率 c.有副反应发生 d.可防止副反应发生 e.容易污染环境 f.可防止污染环境
|
1 |
优点 |
缺点 |
|
甲装置 |
1
|
1
|
|
乙装置 |
1
|
1
|
|
丙装置 |
1
|
1
|
(2)请从甲、乙、丙三装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流左到右方向)为_____________,在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,说明原因_____________________。 [解析]:这是一道评价实验方案的题。该题从是否有副反应发生,是否易控制反应速率,是否防止污染,是否干扰反应产物等方面进行评价。 答案: (1)优点 缺点 甲装置d a、e 乙装置f a、c 丙装置b e、c (2)F-B-E 在Cl2中混有HCl,应在烧瓶和凹形管之间连接一个盛有饱和食盐水的试管,以除去HCl气体。
①仪器连接的顺序(填编号;一起可重复使用)是 。D中浓硫酸的作用是 。实验完毕时,观察到A中的现象是 。
②列出计算Cu的原子量的表达式: 。
③下列情况将使测定结果偏大的是 。
(a)CuO未全部还原为Cu; (b)CuO受潮; (c)CuO中混有Cu。
(2)如果仍采用上图所示的仪器装置,涉及其他方案,还可测定的物理量有 。
(a)m(Cu)和m(CuO); (b)m(N2)和m(H2O);
(c)m(Cu)和m(H2O); (d)m(NH3)和m(H2O)
[例4] 实验室里临时需要用NaOH溶液和CO2来制取纯Na2CO3溶液。已知CO2气体在通入NaOH溶液过程中极易过量生成NaHCO3,且无明显现象。
实验室有下列试剂:①未知浓度的NaOH、②37%的盐酸、③37%的硫酸、④14%的盐酸、⑤大理石、⑥K2CO3固体⑦Cu2(OH)2CO3。
实验室有下列仪器:铁架台、启普发生器、量筒、烧杯、橡皮管、玻璃导管、分液漏斗。
已知下表中各物质在常温时的溶解度(g/100gH2O)。
|
Na2CO3 |
NaHCO3 |
NaCl |
Na2SO4 |
NaHSO4 |
NaOH |
|
15.9 |
8.4 |
35 |
5.5 |
20 |
40 |
(1)本实验应选用的仪器除启普发生器、橡皮管、玻璃导管外,还需要 .
(2)为保证制得的Na2CO3溶液尽量纯,应选用的药品(填编号)除①外,还需要 。
(3)简要叙述实验步骤,直到制得纯Na2CO3溶液(仪器安装可省略)。
(4)根据给出的溶解度表,求出当NaOH溶液中溶质的质量分数大于多少时,在配置过程中会有晶体析出(写出计算步骤和必要的文字说明)?
[解析] 本题的难点在第(3)问。设计依据是依下列反应原理:
CO2+NaOH=NaHCO3
NaOH+NaHCO3=Na2CO3+H2O
利用定量关系及化学反应制得溶液,因题型新颖,思路新巧,故难度较大。
答:(1)烧杯、量筒。(2)④、⑤。(3)①量取一定量的 NaOH溶液,分成两等分;制取CO2,向其中一份NaOH溶液中通入过量的CO2气体③;将两份溶液混匀,摇匀。(4)从表中可知,NaHCO3常温下溶解度为8.4g。
设常温下100g水中溶解的NaOH质量为ⅹ时,达到饱和。
NaOH + CO2 = NaHCO3
40 84