2.乙炔的化学性质
(1)氧化反应
a.燃烧 2CH≡CH+5O2 4CO2+2H2O
4CO2+2H2O
检验其能否被酸性KMnO4溶液所氧化。
[演示实验5-8](另外两名学生操作)打开分液漏斗的活塞,使水缓慢滴下,将生成的乙炔气通入酸性KMnO4溶液中观察现象:片刻后,酸性KMnO4溶液的紫色逐渐褪去。
由此可以得到什么结论?
乙炔气体易被酸性KMnO4溶液氧化。
前边的学习中提到由电石制得的乙炔气体中往往会含有硫化氢、磷化氢等杂质,这些杂质也易被酸性KMnO4溶液氧化,实验中如何避免杂质气体的干扰?
可以将乙炔气先通过装有NaOH溶液(或CuSO4溶液)的洗气瓶而将杂质除去。
b.易被酸性KMnO4溶液氧化
[演示实验5-9]打开分液漏斗的活塞,使水缓慢滴下,将生成的乙炔气体通入溴的四氯化碳溶液中,观察现象:溴的四氯化碳中溴的颜色逐渐褪去。
溴的四氯化碳溶液褪色,说明二者可以反应且生成无色物质,那么它们之间的反应属于什么类型的反应?(属于加成反应)
从时间上来看是乙烯与溴的四氯化碳溶液褪色迅速还是乙炔与之褪色迅速?
(回答)乙烯褪色比乙炔的迅速。
这说明了什么事实?乙炔的叁键比乙烯的双键稳定。
应注意乙炔和溴的加成反应是分步进行的,可表示如下:
(2)加成反应

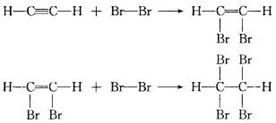
乙炔除了和溴可发生加成反应外,在一定条件下还可以与氢气、氯化氢等发生加成反应。
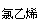

 HC≡CH+HCl H2C==CHCl
HC≡CH+HCl H2C==CHCl
乙炔与乙烯类似,也可以与溴水中的溴发生加成反应而使溴水褪色,且加成也是分步进行的;乙炔与氢气加成时第一步加成产物为乙烯,第二步产物为乙烷,
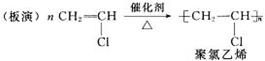
参看教材前边的彩图--塑料管和教材相关内容,了解聚氯乙烯的用途及性能。
[学生活动]自学P128讨论了解聚氯乙烯产品的广泛用途及其优缺点,并总结乙炔的主要用途:重要的化工原料;气割、气焊等。
|
|
乙烷 |
乙烯 |
乙炔 |
|
|
化学 式 |
C2H6 |
C2H4 |
C2H2 |
|
|
电
子
式 |
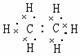 |
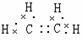 |
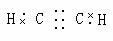 |
|
|
结
构
式 |
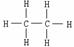 |
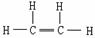 |
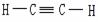 |
|
|
结 构
特 点 |
C - C(单键), 碳原子的化合达 “饱和” |
C = C(双键), 碳原子的化合价未达“饱和” |
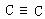 (叁键), (叁键),碳原子的化合价未达“饱和” |
|
|
化 学 活 动 性 |
稳 定 |
活 泼 |
较 活 泼 |
|
|
化 学 性 质 |
取 代 反 应 |
卤代 |
-- |
-- |
|
燃 烧 |
火焰不明亮 |
火焰明亮,带黑烟 |
火焰明亮,带浓黑烟 |
|
|
氧 化 反 应 |
KMnO4溶液不褪色 |
KMnO4溶液褪色 |
KMnO4溶液褪色 |
|
|
加 成 反 应 |
-- |
溴水褪色 |
溴水褪色 |
|
|
聚 合 反 应 |
-- |
能 聚 合 |
能
聚 合 |
|
|
鉴 别 |
KMnO4溶液不褪色或溴水不褪色 |
KMnO4溶液褪色或溴水褪色 |
KMnO4溶液褪色或溴水褪色 |
(引出有机物分子的共线、共面问题)
下列描述CH3 -CH═CH-C≡C-CH3 分子结构的叙述中,正确的是[ BC ]。
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
解析:由乙烯、乙炔分子的空间构型可推出该物质的分子构型为:
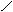
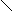 CH3
C≡C-CH3
CH3
C≡C-CH3
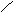
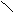 C═C
C═C
H H
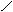
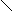 CH3
C≡C-CH3
CH3
C≡C-CH3
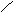
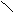 C═C
C═C
H H
如果说乙烯是烯烃也就是含碳碳双键结构的烃的代表的话,那么乙炔也必然是含碳碳叁键的另一类不饱和烃的代表,像这类不饱和烃中也都含有碳碳叁键,我们称之为炔烃。
 CaC2+2H2O C2H2↑+Ca(OH)2
CaC2+2H2O C2H2↑+Ca(OH)2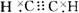 H-C≡C-H 乙炔分子的比例模型
H-C≡C-H 乙炔分子的比例模型