溶液呈的酸碱性何性,取决于溶液中[H+]、[OH-]的相对大小:pH值的大小取决于溶液中的[H+]大小
pH=-lg[H+],pOH=-lgKw=pKw
|
溶液酸碱性 |
[H+]与[OH-]关系 |
||
|
任意湿度 |
室温(mol/L) |
pH值(室温) |
|
|
酸性 |
[H+]>[OH-] |
[H+]>1×10-7 |
<7 |
|
中性 |
[H+]=[OH-] |
[H+]=[OH-]=1×10-7 |
=7 |
|
碱性 |
[H+]<[OH-] |
[H+]>1×与10-7 |
>7 |
(1)酸性越强,pH值越小,碱性越强,pH值越大,pH值减小一个单位,[H+]就增大到原来的10倍,pH值减小n个单位,[H+]的增大到原来的10n倍.
(2)任意水溶液中[H+]≠0,但pH可为0,此时[H+]=1mol/L,一般[H+]>1mol/L时,pH<0,故直接用[H+]表示.
(3)判断溶液呈中性的依据为:[H0]= [OH-]或pH=pOH=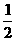 pKw
pKw
只有当室温时,Kw=1×10-14
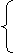 [H+]=[OH-]=10-7mol/L
[H+]=[OH-]=10-7mol/L
溶液呈中性
pH=pOH=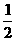 pKw=7
pKw=7
 分析 原因:H2O H++OH-Q
分析 原因:H2O H++OH-Q
由于水的电离是吸热的,湿度越高,电离程度越大,kw越大.
中性:pH=pOH=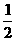 pKw
pKw
T↗→Kw↗→pH+pOH↘
T↘→Kw↘→pH=pOH↗
如:100℃,KW=1×10-12.. pKw=12.
中性时Ph=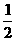 pKw=6<7.
pKw=6<7.
图示:不同湿度(T1>T2)时溶液中[H+]与[OH-],pH与pOH关系
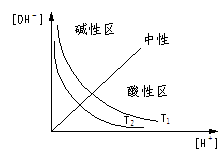
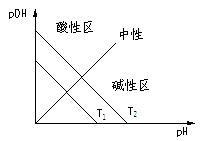
图一 图二
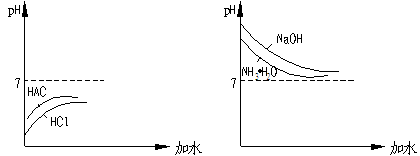
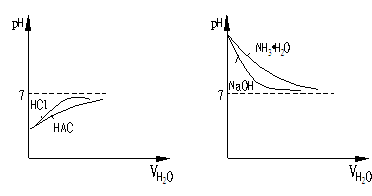
想一想:图一与图二有哪些不同?为何不同?
提示:(①形状 ②T1、T2相对位置)
③简平分钱划分的两个区域酸碱性不同。建议以[H+]、[OH-]=Kw,和pH+pOH=pKw两个关系或考虑,并注意湿度不同时Kw的影响。)
(4)溶液pH的测定方法:
①酸碱指示剂 ②pH试纸 ③pH计其中①只传判定pH范围
②pH试纸也只能确定在某个值左右(对照标准比色卡),无法精确到小数点后1倍。另外使用时不能预先润湿试纸。否则相当于又稀释了待测液,测定结果误差大。
③pH计测定较精确.
 NH4++NH2-
NH4++NH2-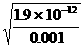 =4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[Cl-]=
=4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[Cl-]=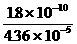 =4.13×10-6<10-5,所以能有效地分离。
=4.13×10-6<10-5,所以能有效地分离。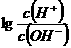 ,则下列叙述正确的是
,则下列叙述正确的是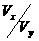 =
(2)若x+y=13时,则
=
(2)若x+y=13时,则 强酸:pH=pH小+0.3
强酸:pH=pH小+0.3
 后
前
后
前 H2O H++OH-
H2O H++OH-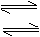 S2-+H2O HS-+OH-(主要)
S2-+H2O HS-+OH-(主要)