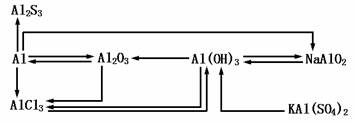
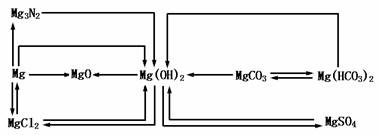
4.Mg(OH)2与Al(OH)3的比较
|
|
Mg(OH)2 |
Al(OH)3 |
|
|
物理 性质 |
均为白色固体,不溶于水 |
||
|
化 学 性 质 |
不稳定性 Mg(OH)2=MgO+ H2O |
不稳定性 2Al(OH)3=Al2O3+3H2O |
|
|
碱性 Mg(OH)2+2H+=Mg2++H2O |
两性Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O |
||
|
制 备 |
Mg2++2OH-=
Mg(OH)2↓ Mg2++2NH3·H2O =Mg(OH)2↓+2NH4+ |
Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 不用强碱 AlO2-+CO2+2H2O= Al(OH)3↓+HCO3- 不用强酸 |
|
3.MgO与Al2O3的比较
|
|
MgO |
Al2O3 |
|
物理 性质 |
均为白色粉末,不溶于水, 熔点高(MgO>Al2O3),是优良的耐火材料 |
|
|
化 学 性 质 |
与热水反应 MgO+H2O=Mg(OH)2 |
与水不反应 |
|
碱性氧化物 MgO+2H+=Mg2++H2O |
两性氧化物 Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O |
|
金属 项目 |
镁(Mg) |
铝(Al) |
|
原子结构 |
|
|
|
原子半径 |
1.60×10-10m |
1.43×10-10m |
|
化合价 |
+2 |
+3 |
|
晶体结构 |
金属晶体 |
金属晶体 |
|
单质 |
物理 性质 |
镁和铝都是密度较小、熔点较低、硬度较小的银白色金属,但镁和铝相比较,铝的硬度比镁的稍大,熔点和沸点都是铝比镁的高 |
|
活泼性 |
较活泼:Mg-2e=Mg2+ |
较活泼:Al-3e=Al3+ |
|
抗腐 蚀性 |
在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有搞腐蚀性能 |
|
|
与O2反应 |
点燃 2Mg+O2 = 2MgO |
△ 4Al+3O2 = 2Al2O3 |
|
与酸 反应 |
Mg+2H+=Mg2++H2↑ |
2Al+6H+=Al3++3H2↑ |
|
与碱 反应 |
不反应 |
2Al+2OH-+2H2O=2AlO2-+3H2↑ |
|
与氧化物反应 |
点燃 2Mg+CO2 = 2MgO+C |
△ 2Al+Fe2O3=Al2O3+2Fe |
|
结论 |
镁、铝均为较活泼的金属,但镁的金属性强于铝 |
|
|
解释 |
核电荷数镁小于铝,而原子半径镁大于铝,故核对最外层的电子引力镁小于铝,即Al比Mg难失电子,金属性弱于Mg |
|
|
主要 用途 |
镁合金汽车、飞机制造、照明弹等 |
铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等 |
1.我们要善于从镁和铝的原子结构、晶体结构的相同和相似的一面认识它们性质的相似性;从结构上不同的一面提示和把握它的性质上相异性以及递变。
镁和铝都是较活泼的金属。在一定条件下,它们都可以和水反应,置换出水中的氢。镁跟冷水便缓慢地反应,加热时反应更为显著。铝和沸水也能微弱的反应,但现象不明显。这一方面是因为镁的金属活动性较铝相对较强,另一个不可忽视的原因是它们的氢氧化物虽然都难溶于水,但Mg(OH)2较Al(OH)3的溶解性相对较大,所以与水反应时生成的Mg(OH)2在镁条表面的覆盖要小,尤其是在加热的条件下(加热时水中的氢离子浓度也相对较大)。但在像在NaOH溶液的强碱性条件下,情况就不一样了。在强碱溶液中,Mg(OH)2的溶解度大为减小,水中的氢离子浓度也减小了,事实证明,镁和强碱溶液不反应,而铝则不然,由于Al(OH)3是典型的两性氢氧化物,它可溶于强碱溶液。即:
Al(OH)3+OH-=AlO2-+2H2O
由上分析可知:铝是一种较活泼的金属,它并不能直接与碱反应,而是先与水反应,2Al+6H2O=2Al(OH)3+3H2↑……①
生成的Al(OH)3是典型的两性氢氧化物,它溶于强碱
Al(OH)3+NaOH=NaAlO2+2H2O……②
将两反应按①+②×2合并,即得总反应方程式:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
所以在上述反应中铝是还原剂,而氧化剂是H2O,不是NaOH。