摘要:3.例题精讲 知识点一:水的电离 [例1](1)与纯水的电离相似.液氨中也存在着微弱的电离:2NH3 NH4++NH2- 据此判断以下叙述中错误的是 ( ) A.液氨中含有NH3.NH4+.NH2-等微粒 B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数 C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-) D.只要不加入其他物质.液氨中C(NH4+) = C(NH2-) (2)完成下列反应方程式 ①在液氨中投入一小块金属钠.放出气体---------------------------- ②NaNH2溶于水的反应---------------------------------- ③类似于“H++OH-=H2O 的反应---------------------------- 解析:此题要求掌握水自偶的实质(水分子电离产生的H+与H2O结合形成H3O+)以及水的电离平衡,并能迁移应用于对于NH3电离的认识:NH3分子电离产生H+和NH2-,H+与NH3结合生成NH4+.液氨电离产生等量的NH2-与NH4+.一定温度下离子浓度乘积为一常数,NH4+类似于H+.NH2-类似于OH-.具备上述知识后.就可顺利完成解题. 答案:(1)C (2)①2Na+2NH3=H2↑+2NaNH2 ②NaNH2+H2O=NaOH+NH3↑或NH2-+H2O=OH-+NH3↑ ③NH2-+NH4+ =2NH3↑或NH4Cl+NaNH2=2NH3↑+NaCl 知识点二:水的离子积 [例2]某温度下纯水中C(H+) = 2×10-7 mol/L.则此时溶液中的C(OH-) = . 若温度不变.滴入稀盐酸使C(H+) = 5×10-6 mol/L.则此时溶液中的C(OH-) = . 解析:由水电离产生的H+与OH-量始终相等.知纯水中C(H+) = C(OH-).根据纯水中C(H+) 与C(OH-)可求出此温度下水的Kw的值.由Kw的性质(只与温度有关.与离子浓度无关).若温度不变.稀盐酸中Kw仍为此值.利用此值可求出盐酸中的C(OH-). 答案:纯水中 C(OH-) = C(H+) = 2×10-7 mol/L Kw = C(H+)·C(OH-) = 2×10-7×2×10-7 = 4×10-14 稀盐酸中 C(OH-) = Kw / C(H+) = (4×10-14) / (5×10-6) = 8×10-9 mol/L [例3] .难溶化合物的饱和溶液存在着溶解平衡.例如: AgCl(s) Ag++Cl-,Ag2CrO4(s) 2Ag++CrO42-,在一定温度下.难溶化合物饱和溶液离子浓度的乘积为一常数.这个常数用Ksp表示. 已知:Ksp=[Ag+][Cl-]=1.8×10-10 Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.9×10-12 现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液.试通过计算回答: (1)Cl-和CrO42-中哪种先沉淀? (2)当CrO42-以Ag2CrO4形式沉淀时.溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(设当一种离子开始沉淀时.另一种离子浓度小于10-5mol/L时.则认为可以达到有效分离) 解析:(1)当溶液中某物质离子浓度的乘积大于Ksp时.会形成沉淀.几种离子共同沉淀某种离子时.根据各离子积计算出所需的离子浓度越小越容易沉淀.(2)由Ag2CrO4沉淀时所需Ag+浓度求出此时溶液中Cl-的浓度可判断是否达到有效分离. 解答:(1)AgCl饱和所需 Ag+浓度[Ag+]1=1.8×10-7摩/升 Ag2CrO4饱和所需Ag+浓度[Ag+]2==4.36×10-5摩/升 [Ag+]1<[Ag+]2.Cl-先沉淀. (2) Ag2CrO4开始沉淀时[Cl-]==4.13×10-6<10-5.所以能有效地分离. 知识点三:水的电离平衡的移动 [例4] :某溶液中由水电离出来的C(OH-)=10-12mol/L.则该溶液中的溶质不可能是( ) A.HCl B.NaOH C.NH4Cl D.H2SO4 解析:由水电离反应式知:此溶液水电离产生的C(H+)=C(OH-) =10-12mol/L.若溶液中的H+全部来自水的电离.则此溶液显碱性.是因溶有碱类物质所致.若溶液中的H+不仅为水电离所产生.则此溶液显酸性.为酸性物质电离所致.NH4Cl不可能电离产生H+. 解答:C 下列两题为上题的变式.分析一下变在何处?解题方法.思路与上题是否一样?差异何在? (1)室温下.在纯水中加入某物质后.测得溶液中由水电离产生的C(H+)=10-12mol/L.则加入的物质可能是(假设常温下碳酸.氢硫酸的第一步电离度为0.1%) ( ) A.通入CO2 B.通入H2S C.通入NH3 D.加入NaHSO4 (2)某溶液中水电离产生的C(H+)=10-3mol/L.,该溶液中溶质可能是( ) ①Al2(SO4)3 ②NaOH ③NH4Cl ④NaHSO4 A.①② B.①③ C.②③ D.①④ [例5]能促进水的电离.并使溶液中C(H+)>C(OH-)的操作是 ( ) 向水中投入一小块金属钠 (3)向水中通CO2 (4)向水中通NH3 (5)向水中加入明矾晶体 (6)向水中加入NaHCO3固体 (7)向水中加NaHSO4固体 A. 解析:本题主要考查外界条件对水的电离平衡的影响.请按如下思路完成本题的解:本题涉及到哪些条件对水的电离平衡的影响?各自对水的电离平衡如何影响?结果任何(C(H+)与C(OH-)相对大小)?归纳酸.碱.盐对水的电离平衡的影响. 解答: D 知识点四:pH的定义方法 [例6].下列溶液.一定呈中性的是 ( ) A.由等体积.等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液 B.[H+]=1×10-7mol·L-1的溶液 C.pH=14-pOH 的溶液 D.pH=pOH 的溶液 解析:此题要求将教材中定义pH方法迁移应用于表示pOH以及pH与pOH的关系.根据pH的定义方法.可定义pOH= ―lgC(OH―).将室温下水的离子积的表达式C(H+)×C(OH-)=10―14两边取负对数.―lgC(H+)―lgC(OH―)= ―lg10―14.整理得pH+pOH=14.应用所得关系式分析可得答案. 解答:D 点评:pOH= ―lgC(OH―).pH+pOH=14两个关系式及其应用均不在教学大纲和考纲范围内.我们不一定要掌握.但将教材中的知识.方法加以迁移应用.进行探究发现是教学大纲和考纲提出的能力要求.此题作为全国高考化学测试题具有重要的指导意义.值得大家认真去领悟.在随后的2001年上海高考题以及2002年全国理科综合高考题中又出现了类似的题目. 为更好地表示溶液的酸碱性.科学 家提出了酸度(AG)的概念.AG=.则下列叙述正确的是 A 中性溶液的AG=0 B 酸性溶液的AG<0 C 常温下0.lmol/L氢氧化钠溶液的AG=12 D 常温下0.lmol/L盐酸溶液的AG=12 有人曾建议用AG表示溶液的酸度.AG的定义为AG=lg([H+]/[OH-]).下列表述正确的是 A 在25℃时.若溶液呈中性.则pH=7.AG=1 B 在25℃时.若溶液呈酸性.则pH<7.AG<0 C 在25℃时.若溶液呈碱性.则pH>7.AG>0 D 在25℃时.溶液的pH与AG的换算公式为AG=2 知识点五:溶液pH的计算 [例7]室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH溶液.则n:m=-------------- 解析:此题是关于两种不反应的溶液混合后溶液pH值的计算.根据混合前后溶质量守恒.列式求解 解答:pH=10 C(H+)=10-10mol/L C(OH-) =10-4mol/L pH=13 C(H+)=10-13mol/L C(OH-) =10-1mol/L pH=12 C(H+)=10-12mol/L C(OH-) =10-2mol/L 10-4·n + 10-1·m = (n+m) ×10-2 n :m = 100 :11 规律: 有关混合溶液的pH计算.题设条件可千变万化.正向.逆向思维.数字与字母交替出现.但基本题型只有两种:混合后反应.对于溶液的稀释.可将水作为浓度为0的溶液.仍属混合后不反应一类.这一类混合溶液的pH应介于两种溶液的pH之间.因而酸.碱溶液无论加多少水稀释.其最终pH均不可能等于纯水的pH. 混合溶液pH的计算方法也很简单.即设法求出混合溶液的C(H+).若是溶液显碱性.则必须先求出溶液的C(OH-).然后再换算为C(H+)或按OH-量守恒列式求解. [例8]25ºC.若10体积的某强碱溶液与1体积的某强酸溶液混合后.溶液呈中性.则混合之前.该碱的pH与强酸的pH之间该满足的关系是 分析:由题意知.本题为酸.碱混合后完全中和.根据中和反应的实质可知.酸中n(H+)与碱中n(OH-)相等.故有C(H+)酸V酸 == C(OH-)碱V碱.由此关系列式可求得结果. 解答:设酸的pH为a.C(H+)酸=10-a.碱的pH为b.C(OH-)碱=10-14 / 10-b=10- 因为混合后溶液呈中性.所以C(H+)酸V酸 == C(OH-)碱V碱 10-a ×V = 10 - ×10V = 10 - ×V 10-a = 10 - 两边取负对数:-lg10-a = -lg10 - .a=13-b a+b=13 即酸的pH与碱的pH之和为13 点评:上面解法尽管可顺利地得出本题的解.但题中的酸碱体积比可以任意变换.则每一变换都得重新求解.这就启发我们能否找出酸.碱pH与两者体积比之间的关系呢?同时若混合后不显中性其关系又会怎样呢? 将上面的解改为: C(H+)酸V酸 == C(OH-)碱V碱 10-a ×V酸 = 10 - ×V碱 10-a·10-b=10-14·(V碱 / V酸) 两边取负对数得:a+b=14―lg(V碱 / V酸) 若混合后溶液显酸性------------------------: 若混合后溶液显碱性-------------------------: 同学们在学习中要善于总结.积累.把自己积累的经验.成果用于指导自己的学习.例如掌握了上述关系后.解下列题目就很轻松. 在20℃时.有PH值为x的盐酸和PH值为y的NaOH溶液.取Vx升该盐酸同该NaOH溶液中和.需Vy升NaOH溶液 (1)若x+y=14时.则= (2)若x+y=13时.则= (3)若x+y>14时.则= .且Vx Vy
网址:http://m.1010jiajiao.com/timu3_id_51069[举报]
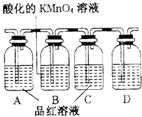 中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去).请回答下列有关问题.
中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去).请回答下列有关问题.(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中.则A与C反应的离子方程式为
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(2)若C、D均为气体,且都能使澄清石灰水变浑浊,某探究性学习小组利用如图中所列装置设计实验,证明上述反应中有C、D生成.则B瓶溶液的作用是
除去产物气流中的SO2
除去产物气流中的SO2
,装置D中所盛溶液是澄清石灰水
澄清石灰水
,若要验证另一产物水的存在,需使用的药品为无水硫酸铜
无水硫酸铜
,该装置在整套装置中的位置是A前
A前
.(3)若C是无色有刺激性气味的气体,其水溶液呈弱碱性.写出C发生催化氧化反应的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| 催化剂 |
4NH3+5O2
4NO+6H2O
.
| ||
| 催化剂 |
(4)若D为氯碱工业的主要原料,C是造成温室效应的主要气体之一,则上述的反应的化学方程式为
2HCl+Na2CO3=2NaCl+CO2↑+H2O或HCl+NaHCO3=NaCl+CO2↑+H2O
2HCl+Na2CO3=2NaCl+CO2↑+H2O或HCl+NaHCO3=NaCl+CO2↑+H2O
.根据下列有机化合物,回答问题。
(1)上述互为同分异构体的化合物为 ;
(2)写出丙中官能团的名称 ;
(3)丁在一定条件下,可以发生水解反应,生成X、Y两种物质(相对分子质量:X<Y)。由X经下列反应可制得N、F两种高分子化合物,它们都是常用的塑料。
(ⅰ)X转化为M的反应类型是 。写出N的结构简式:
(ⅱ)写出B转化为C的化学方程式 ;
(ⅲ)在一定条件下,E分子能脱去水形成多种化合物:
①请写出两分子E脱去一分子水的反应的化学方程式 ;
②在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为 。
查看习题详情和答案>>
已知水的密度p=1.0×103kg/m3、摩尔质量M=1.8×10-2kg,阿伏加德罗常数NA=6.0×1023mol-1,一滴露水的体积大约是6.0×10-5cm3,它含有 个水分子,如果一只极小的虫子来喝水,每分钟喝进6.0×107个水分子时,喝进水的质量是 kg(保留两位有效数字)(共6分)
查看习题详情和答案>>