[23].(10分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
[23].(10分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
(1)若甲是短周期金属单质,乙、丙是短周期非金属单质。X、Y、Z中只有一种是离子晶体,试推断:
①含有丙元素的化合物是 (填X、Y、Z)
②工业上有些气体中也含有一定量的Z成分,试列举工业上含Z成分的气体 。
③X与甲反应的化学方程式 。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常状况下是深红棕色液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出甲、乙、丙的化学式 。
②写出X与足量的甲在溶液中完全反应的离子方程式 。
24].(15分)人们对原子结构的认识是一个不断深化的过程。
(1)19世纪初英国物理学家和化学家 提出了近代原子论,他的观点奠定了近代化学发展的基础,他本人被誉为“进代化学之父”。他的原子学说的最主要观点是_________(虽然该观点现在看来是错误的)。
(2)19世世纪末,人们对原子结构的认识因为三个重要的科学发现而逐步得到提升。
①请填写下表
|
科学家 |
重要发现 |
有关性质 |
|
贝可勒尔 |
|
能使照相底片感光 |
|
|
|
具有巨大穿透能力 |
|
|
发现了电子 |
带负电荷 |
②这三个重要发现证明了一点,那就是 。
(3)英国科学家 随即于1903年提出了原子结构的葡萄干面包模型。该模型示意如右图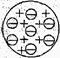 。他认为原子中的正电荷 分布在整个原子的球体内。而电子又均匀地分布在 ,整个原子的正电荷所带电量必然 电子所带负电荷电量。
。他认为原子中的正电荷 分布在整个原子的球体内。而电子又均匀地分布在 ,整个原子的正电荷所带电量必然 电子所带负电荷电量。
(4)在这三个重大发现的基础上,20世纪初英国物理学家卢瑟福进一步研究起元素的衰变和放射性,发现了 。1909年,卢瑟福和盖革等人用α粒子轰击金箔时,发现绝大多数α粒子不发生偏转,少数α粒子发生很大偏转,有个别α粒子反弹回来。这个结果用葡萄干面包模型不能解释。但却使卢瑟相对原子结构产生了以下两个主要观点:① ;② 。于是1911年,卢瑟福提出了原子结构的 模型,即 ,澄清了人们对原子结构的错误认识。
(5)卢瑟福的原子结构模型尽管能解释一些实验事实。但它没有解决原子核外电子运动状况和原子核组成。原子结构理论还需进一步发展。
①玻尔的原子同心结构壳层模型是卢瑟福原子结构模型的进一步发展。玻尔认为,原子核外电子只能处在 的特定轨道上运动,电子的能量是不连续的,电子在不同能量轨道间“跃迁”时能量变化也是不连续的。这一思想为我们提供了原子核外电子 排布的信息。
②核外电子的运动规律用宏观经典的轨道不能描述。现在科学家已用 形象地描述核外电子的运动状态。
③1919年,卢瑟福用α粒子轰击氮原子(14N)时,发现了质子(核反应方程式 ),并大胆作出原子核中存在中子的假说。1932年英国物理学家 自觉地用中于假说指导自己的实验(α粒子轰击铍9Be原子),并证实了原子核内中子的存在(核反应方程式 )。上述材料说明①假说是科学发现中的一种重要方法,它可以 ;②假说要发展成为科学理论,必须 。
(6)判断下列说法是否正确,在每小题后的括号内画“√”或“×”
|
①“古典原子论”、“一日之棰,日取其半,万世不竭”等观点,敲开了人们探索原子结构的大门。( ) |
②电子的发现,揭示了原子的可分性,是人们探索原子结构的一个重大突破。具有里程碑的意义。( ) |
|
③元素放射性衰变是由原子核引起的。是原子核自发变化的一种行为,它的发现是人类认识原子核的开始。( ) |
④卢瑟相原子模型的意义在于提出了原子有核的思想,将原子分为核内和核外,这为原子结构理论进一步发展奠定了基础。( ) |
(7)原子结构模型的演变过程表明 (多项选择,选填序号)
|
A 人类对事物的认识是不断深化完善的,永无止境的。 |
B 采用物理模型是研究化学问题的一种极好思维方法。 |
|
C 三大科学发现推动了原子学说的发展。随着科学技术的不断进步,人类对原子结构的认识还会继续深化。 |
D 科学理论的发展从不完善到完善,这在许多科学领域都存在,重要的是敢于设想勇于实践。 |
20].在四个密闭容器中分别装有下表所示的一定量的物质,将它们加热至300℃,经充分反应后排出气体,则残留固体及其物质的量正确的是
|
|
A |
B |
C |
D |
|
反应前 |
1mol
NaOH、1mol NaHCO3 |
1mol
Na2O2、1mol NaHCO3 |
1mo1
Na2O2、2mol NaHCO3 |
1mol
Na2O2、1mol NH4HCO3 |
|
反应后 |
1mol
Na2CO3 |
2mol
NaOH、0.5mol Na2CO3 |
2mol
NaOH、1mol Na2CO3 |
1mol
Na2CO3 |
|
一 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
二 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
|
19].在容积不变的密闭容器中,在一定条件下发生反应2A(?)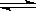 B(g)+C(s),达到化学平衡后,其他条件不变,升高温度时,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,其他条件不变,升高温度时,容器内气体的密度增大,则下列叙述正确的是
A 若正反应是吸热反应,则A为气态 B 若正反应是放热反应,则A为气态
C 改变压强对平衡的移动无影响 D 在平衡体系中加入少量C,则平衡向逆反应方向移动
18].下列实验设计能够成功的是
|
|
实验目的 |
实验步骤及现象 |
|
A |
检验亚硫酸钠试样是否变质 |
 |
|
B |
检验某卤代烃是否是氯代烃 |
 |
|
C |
证明酸性条件H2O2氧化性比I2强 |
 |
|
D |
除去氯化钠晶体中少量硝酸钾 |
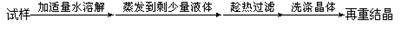 |
2006年浙江省名校高二化学竞赛联考(十)
(时间:120分钟 满分:150分)
班级: 姓名:
|
H 1.008 |
相对原子质量 |
He 4.003 |
|||||||||||||||
|
Li 6.941 |
Be 9.012 |
|
B 10.81 |
C 12.01 |
N 14.01 |
O 16.00 |
F 19.00 |
Ne 20.18 |
|||||||||
|
Na 22.99 |
Mg 24.31 |
Al 26.98 |
Si 28.09 |
P 30.97 |
S 32.07 |
Cl 35.45 |
Ar 39.95 |
||||||||||
|
K 39.10 |
Ca 40.08 |
Sc 44.96 |
Ti 47.88 |
V 50.94 |
Cr 52.00 |
Mn 54.94 |
Fe 55.85 |
Co 58.93 |
Ni 58.69 |
Cu 63.55 |
Zn 65.39 |
Ga 69.72 |
Ge 72.61 |
As 74.92 |
Se 78.96 |
Br 79.90 |
Kr 83.80 |
|
Rb 85.47 |
Sr 87.62 |
Y 88.91 |
Zr 91.22 |
Nb 92.91 |
Mo 95.94 |
Tc [98] |
Ru 101.1 |
Rh 102.9 |
Pd 106.4 |
Ag 107.9 |
Cd 112.4 |
In 114.8 |
Sn 118.7 |
Sb 121.8 |
Te 127.6 |
I 126.9 |
Xe 131.3 |
|
Cs 132.9 |
Ba 137.3 |
La-Lu |
Hf 178.5 |
Ta 180.9 |
W 183.8 |
Re 186.2 |
Os 190.2 |
Ir 192.2 |
Pt 195.1 |
Au 197.0 |
Hg 200.6 |
Tl 204.4 |
Pb 207.2 |
Bi 209.0 |
Po [210] |
At [210] |
Rn [222] |
|
Fr [223] |
Ra [226] |
Ac-La |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
|
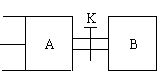 [27].(7分)如图,A中有一可自由移动的活塞,关闭开关K,先向B中充入2mol X和2mol Y,再向A中充入1mol X和1mol Y。起始时A、B的体积都为a L,在相同的温度和有催化剂存在的条件下,两容器中都开始发生下述反应X(g)+Y(g)
[27].(7分)如图,A中有一可自由移动的活塞,关闭开关K,先向B中充入2mol X和2mol Y,再向A中充入1mol X和1mol Y。起始时A、B的体积都为a L,在相同的温度和有催化剂存在的条件下,两容器中都开始发生下述反应X(g)+Y(g) (A)=
。
(A)=
。
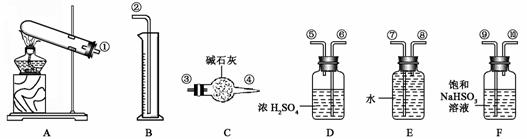
 CuO+SO2↑+SO3↑+O2↑(未配平),便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑(未配平),便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示: