摘要:[23].如图所示.甲.乙.丙是三种常见单质.X.Y.Z是常见化合物.它们之间有如下转化关系: (1)若甲是短周期金属单质.乙.丙是短周期非金属单质.X.Y.Z中只有一种是离子晶体.试推断: ①含有丙元素的化合物是 ②工业上有些气体中也含有一定量的Z成分.试列举工业上含Z成分的气体 . ③X与甲反应的化学方程式 . (2)若甲是具有氧化性的黄绿色气体单质.丙通常状况下是深红棕色液体.Y和Z具有相同的阳离子.X与Z含有相同的阴离子.试推断: ①写出甲.乙.丙的化学式 . ②写出X与足量的甲在溶液中完全反应的离子方程式 .24].人们对原子结构的认识是一个不断深化的过程. (1)19世纪初英国物理学家和化学家 提出了近代原子论.他的观点奠定了近代化学发展的基础.他本人被誉为“进代化学之父 .他的原子学说的最主要观点是 (虽然该观点现在看来是错误的). (2)19世世纪末.人们对原子结构的认识因为三个重要的科学发现而逐步得到提升. ①请填写下表 科学家 重要发现 有关性质 贝可勒尔 能使照相底片感光 具有巨大穿透能力 发现了电子 带负电荷 ②这三个重要发现证明了一点.那就是 . (3)英国科学家 随即于1903年提出了原子结构的葡萄干面包模型.该模型示意如右图.他认为原子中的正电荷 分布在整个原子的球体内.而电子又均匀地分布在 .整个原子的正电荷所带电量必然 电子所带负电荷电量. (4)在这三个重大发现的基础上.20世纪初英国物理学家卢瑟福进一步研究起元素的衰变和放射性.发现了 .1909年.卢瑟福和盖革等人用α粒子轰击金箔时.发现绝大多数α粒子不发生偏转.少数α粒子发生很大偏转.有个别α粒子反弹回来.这个结果用葡萄干面包模型不能解释.但却使卢瑟相对原子结构产生了以下两个主要观点:① ,② .于是1911年.卢瑟福提出了原子结构的 模型.即 .澄清了人们对原子结构的错误认识. (5)卢瑟福的原子结构模型尽管能解释一些实验事实.但它没有解决原子核外电子运动状况和原子核组成.原子结构理论还需进一步发展. ①玻尔的原子同心结构壳层模型是卢瑟福原子结构模型的进一步发展.玻尔认为.原子核外电子只能处在 的特定轨道上运动.电子的能量是不连续的.电子在不同能量轨道间“跃迁 时能量变化也是不连续的.这一思想为我们提供了原子核外电子 排布的信息. ②核外电子的运动规律用宏观经典的轨道不能描述.现在科学家已用 形象地描述核外电子的运动状态. ③1919年.卢瑟福用α粒子轰击氮原子(14N)时.发现了质子(核反应方程式 ).并大胆作出原子核中存在中子的假说.1932年英国物理学家 自觉地用中于假说指导自己的实验(α粒子轰击铍9Be原子).并证实了原子核内中子的存在(核反应方程式 ).上述材料说明①假说是科学发现中的一种重要方法.它可以 ,②假说要发展成为科学理论.必须 . (6)判断下列说法是否正确.在每小题后的括号内画“√ 或“× ①“古典原子论 .“一日之棰.日取其半.万世不竭 等观点.敲开了人们探索原子结构的大门.( ) ②电子的发现.揭示了原子的可分性.是人们探索原子结构的一个重大突破.具有里程碑的意义.( ) ③元素放射性衰变是由原子核引起的.是原子核自发变化的一种行为.它的发现是人类认识原子核的开始.( ) ④卢瑟相原子模型的意义在于提出了原子有核的思想.将原子分为核内和核外.这为原子结构理论进一步发展奠定了基础.( ) (7)原子结构模型的演变过程表明 A 人类对事物的认识是不断深化完善的.永无止境的. B 采用物理模型是研究化学问题的一种极好思维方法. C 三大科学发现推动了原子学说的发展.随着科学技术的不断进步.人类对原子结构的认识还会继续深化. D 科学理论的发展从不完善到完善.这在许多科学领域都存在.重要的是敢于设想勇于实践.
网址:http://m.1010jiajiao.com/timu3_id_435287[举报]
(2012?太原一模)X、Y、Z、U、W为原子序数依次增大的前四周期元素,X、Y、Z三种元素的基态原子具有相同的能层和能级,且第一电离能:I1(X)<I1(Z)<I1(Y),其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体.U为周期表前四周期中电负性最小的元素,W的原子序数为26.试回答下列问题:
(1)XZ2的电子式为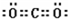
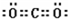 ,基态W原子的核外电子排布式为
,基态W原子的核外电子排布式为
(2)Y的简单氢化物极易溶于Z的简单氢化物中,其主要原因是
(3)X的一种氢化物的相对分子质量为26,其分子中σ键与π键的键数之比为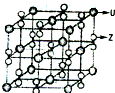
(4)化合物甲由Z、U两元素组成,其晶胞如图所示.
①甲的化学式为
②下列有关该晶体的说法正确的是
A.每个晶胞中含有14个U+和13个Z-2
B.晶体中每个U+周围距离U+最近的Z-2有8个
C.晶体中与每个U+距离最近的U+有12个
D.该晶体属于离子晶体
③甲的密度为a g?cm-3,则晶胞的体积是
cm3(只要求列出计算式,阿伏加德罗常数用NA表示).
查看习题详情和答案>>
(1)XZ2的电子式为
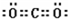
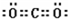
1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
.(2)Y的简单氢化物极易溶于Z的简单氢化物中,其主要原因是
这两种氢化物均为极性分子,氨气和水分子之间能形成氢键
这两种氢化物均为极性分子,氨气和水分子之间能形成氢键
.(3)X的一种氢化物的相对分子质量为26,其分子中σ键与π键的键数之比为
3:2
3:2
;其分子中X原子的杂化轨道类型为sp
sp
.
(4)化合物甲由Z、U两元素组成,其晶胞如图所示.
①甲的化学式为
KO2
KO2
②下列有关该晶体的说法正确的是
CD
CD
(填字母编号).A.每个晶胞中含有14个U+和13个Z-2
B.晶体中每个U+周围距离U+最近的Z-2有8个
C.晶体中与每个U+距离最近的U+有12个
D.该晶体属于离子晶体
③甲的密度为a g?cm-3,则晶胞的体积是
| 284 |
| aNA |
| 284 |
| aNA |
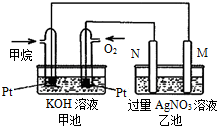 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.(1)反应物能量总和
(2)若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是
(4)如图所示的甲池装置是由CH4、O2和KOH溶液组成的新型燃料电池,利用该装置可以将
(5)乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(6)M电极的材料是
(7)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为
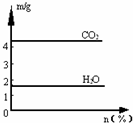 将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( ) 将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
|
查看习题详情和答案>>
 分别回答下列问题.
分别回答下列问题.(1)从H+、Na+、Cu2+、Cl-、S
| O | 2- 4 |
①电解过程中溶液颜色变浅且水量不变
CuCl2
CuCl2
;②电解过程中电解质含量不变,水量减少
H2SO4或Na2SO4
H2SO4或Na2SO4
;③电解过程中,两极析出气体的体积比为1:1
HCl或NaCl
HCl或NaCl
.(2)①用惰性电极电解硫酸铜溶液,若阴极上有1.6克铜析出,则阳极上产生的气体在标准状况下的体积约为
0.28L
0.28L
;②用铂电极电解0.02mol/L硫酸铜溶液,直至铜完全析出,所得溶液中氢离子浓度为(忽略溶液体积的变化)
0.04mol/L
0.04mol/L
;③已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1)△H=-571.6KJ;C3H8(g)+5O2(g)=3CO2(g)+4H2O(1)△H=-2220.0kJ实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则混合气体中氢气与丙烷的体积比是
3:1
3:1
.(3)如图所示,甲、乙两试管中各放一枚铁钉,甲试管中为NaCl溶液,乙试管为稀醋酸溶液,数天后观察到的现象
是
U形管左端液面上升,右边液面下降
U形管左端液面上升,右边液面下降
,甲中正极反应为O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
,乙中正极反应为2H++2e-=H2↑
2H++2e-=H2↑
. 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的
碳
碳
棒,乙池中的铁
铁
棒.②乙池中阳极的电极反应式是
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
.(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
.
| ||
②甲池中碳极上电极反应式是
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
,乙池碳极上电极反应属于氧化反应
氧化反应
(填“氧化反应”或“还原反应”).③若乙池转移0.02mol e-后停止实验,池中溶液体积是200mL,则溶液混合均匀后的所得NaOH溶液的物质的量浓度为
0.1mol/L
0.1mol/L
.