24.(6分)有一包由硝酸钾和不溶性杂质组成的固体混合物投入一定量的水中,在保证无水分蒸发的前提下,改变温度,测得固体混合物的溶解情况如下:
表一 实验结果
|
温度/℃ |
10 |
40 |
75 |
|
剩余固体/g |
261 |
175 |
82 |
表二 硝酸钾在不同温度时的溶解度
|
温度/℃ |
10 |
40 |
50 |
60 |
65 |
80 |
|
溶解度/g |
20.9 |
63.9 |
85.5 |
110 |
126 |
169 |
|
温度/℃ |
10 |
40 |
50 |
60 |
65 |
80 |
|
溶解度/g |
20.9 |
63.9 |
85.5 |
110 |
126 |
169 |
|
温度/℃ |
10 |
40 |
50 |
60 |
65 |
80 |
|
溶解度/ g |
20.9 |
63.9 |
85.5 |
110 |
126 |
169 |
通过计算回答:
(1)实验过程中所用水的质量是________。
(2)对75℃时所得溶液的下列说法中正确的是
A.该溶液是饱和溶液 B.该溶液是不饱和溶液
C.82g剩余固体中一定含有硝酸钾 D.82g剩余固体中可能含有硝酸钾
(3)原固体混合物中含硝酸钾的质量。
22.(12分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1∶1或2∶1形成化合物;B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
 ⑴写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、_____________。
⑴写出只含有A、B、D、E四种元素的两种无水盐的化学式_____________、_____________。
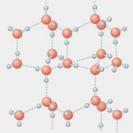
⑵右图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 ,与每个“构成粒子”相邻的粒子呈 空间构型。E与D按原子个数比1∶1形成的化合物的电子式为 。
⑶人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F-D |
F-F |
B-B |
F-B |
C=D |
D=D |
|
键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示): 。
a.F与B形成的化合物 b.B与D形成的稳定化合物 c. F的单质
②试估算1mol F单质晶体完全燃烧放出的热量: 。
六,(包括一小题共8分)
21.(12分) 下表是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“……”的四种元素外,其余元素都给出了该种元素的全部该类数据。
|
(H) 13.6 |
|
(He) 24.6 54.4 |
|||||
|
(Li) 5.4 75.6 122.5 |
(Be) 9.3 18.2 153.9 217.7 |
(B) 8.3 25.2 37.9 259.4 340.2 |
(C) 11.3 24.4 47.9 64.5 392.1 489.9 |
(N) 14.5 29.6 47.4 72.5 97.9 552.1 …… |
(O) 13.6 35.1 …… …… …… …… …… …… |
(F) 17.4 34.9 …… …… …… …… …… …… …… |
(Ne) 21.6 41.6 …… …… …… …… …… …… …… …… |
研究这些数据,回答下列问题:
(1)每组数据可能是该元素的________(填序号)
A.原子得到电子所放出的能量 B.原子半径的大小
C.原子逐个失去电子所吸收的能量 D.原子及形成不同分子的半径的大小
(2)分析同周期自左向右各元素原子的第一个数据:
①总体变化趋势是_______________(填“增大”或“减小”);
②与前后元素相比,由于该元素的数值增大较多而变得反常的元素位于元素周期表的________________族;
③根据你分析所得的变化规律推测,镁和铝的第一个数据的大小关系为Mg(1)______Al(1)(填“大于”或“小于”)。
(3) 分析每个元素的一组数据:
①有些元素的一组数据中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中_____________________________________________________的结论。
②根据这个规律,你认为氧元素8个数据中出现“突跃”的数据应该是第_____个
(每空2分,共12分 )
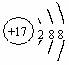 下列化学用语表达正确的是
下列化学用语表达正确的是
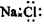 C.NaCl的电子式:
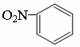
D.硝基苯的结构简式:
C.NaCl的电子式:
D.硝基苯的结构简式: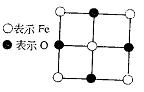 (2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中Fe2+所占分数(用小数表示,精确到0.001)为多少?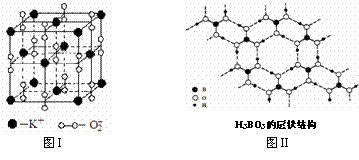 下图表示两种晶体的微观结构:
下图表示两种晶体的微观结构:
 (12分)某无色溶液,其中可能存在的离子有:Na+、Ag+、Fe3+、Ba2+、Al3+、AlO2-、S2-、SO
(12分)某无色溶液,其中可能存在的离子有:Na+、Ag+、Fe3+、Ba2+、Al3+、AlO2-、S2-、SO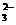 、SO
、SO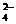 ,现取该溶液进行A、B、C三步实验,实验结果如下:
,现取该溶液进行A、B、C三步实验,实验结果如下: