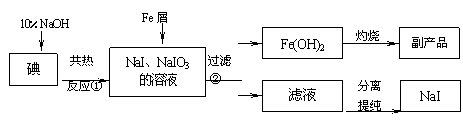
32.(22分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:① 为氯气发生装置;
② 的试管里盛有15 mL 30% KOH溶液。并置于水浴中;
③ 的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;
④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
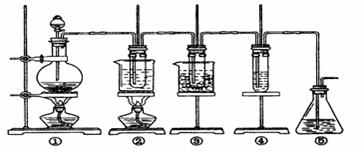
⑴制取氯气时,在烧瓶里加入一定量的二氧化锰。通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
 A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
⑵比较制取氯酸钾和次氯酸钠的条件,
二者的差异是:
反应完毕经冷却后,②的试管中有大
量晶体析出。右图中符合该晶体溶解
度曲线的是 (填写编号字母);
从②的试管中分离出该晶体的方法是 (填写实验操作名称);
⑶本实验中制取次氯酸钠的离子方程式是: 。
⑷实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为 色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
|
|
然后溶液从无色逐渐变为
色 |
|
30.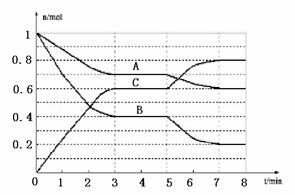 (16分)在一体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化 如右图所示。已知,平衡后,降低温度,A的转化率增大。
(16分)在一体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化 如右图所示。已知,平衡后,降低温度,A的转化率增大。
⑴根据上图数据,从反应开始到达第一次平衡时的平均速率v(A)为 。
⑵写出此反应的平衡常数表达式:K= ;此正反应为 (填“吸热”或“放热”)反应。
⑶已知在5~7min内平衡常数K值增大,则此处曲线
变化的原因是 。
 ⑷下图表示此反应的反应速率v和时间t的关系图
⑷下图表示此反应的反应速率v和时间t的关系图
各阶段的平衡常数如下表所示:
|
t2 ~ t3 |
t4 ~ t5 |
t5 ~ t6 |
|
K1 |
K2 |
K3 |
根据上图判断,K1.K2.K3之间的关系为: (用“>”.“<”或“=”连接)。C的平衡百分含量最高的一段时间是 。
⑸工业上生产硫酸,其中重要的一步反应是:
2SO2(g)+O2
(g)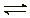 2SO3(g)
2SO3(g)
①生产中同时提高反应速率和SO2的转化率,下列措施可行的是 (填字母)。
A.向装置中充入过量的SO2 B.向装置中充入过量的O2
C.使用更高效的催化剂 D.升高温度
②硫酸工业尾气中二氧化硫含量超过0.055%(体积分数)时需要加以处理后才能排放。现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2 L(标准状况)时,碘水恰好褪色。通过计算用数字说明该尾气能否直接排放
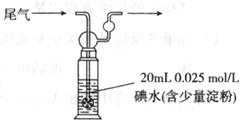 (已知:
(已知: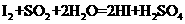 )
)


 徐闻中
徐闻中 
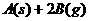

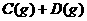 已达平衡的是:
已达平衡的是: