2.根据下列实验现象,所得结论正确的是 ( )
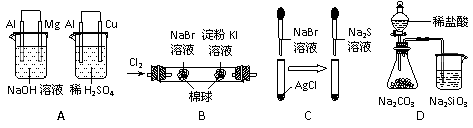
|
实验 |
实验现象 |
结论 |
|
A |
左烧杯中镁表面有气泡,右烧杯中铜表面有气泡 |
活动性:Al>Mg>Cu |
|
B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C |
白色固体先变为淡黄色,后变为黑色 |
溶解度:AgCl>AgBr>Ag2S |
|
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
22.(10分)有A、B、C、D四种强电解质,它们均易溶于水,在水中电离时可产生下列离子:(每种物质只含一种阳离子和一种阴离子互不重复)
|
阳离子 |
K+、Na+、Ba2+、NH4+ |
|
阴离子 |
CH3COO–、Cl–、OH–、SO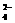 |
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离程度相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)写出C溶液和D溶液反应的化学方程式: 。
(2)25℃时pH = 9的A溶液和pH = 9的C溶液中水的电离程度小的是 (填写A或C的化学式)。
(3)25℃时用惰性电极电解D的水溶液,一段时间后溶液的pH 7(填“>”、“<”或“=”)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 。
(5)室温时在一定体积0.2 mol·L–1的C溶液中,加入一定体积的0.1 mol·L–1的盐酸时,混合溶液的pH = 13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 。
21.(10分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL0.2mol·L–1的醋酸溶液,用0.2mol·L–1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL0.2mol·L–1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、
和 。
(2)为标定某醋酸溶液的准确浓度,用0.2000mol·L–1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
|
实验序号 |
1 |
2 |
3 |
4 |
|
消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为 。(保留小数点后四位)
实验二探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
|
醋酸浓度 (mol·L–1) |
0.00l 0 |
0.010 0 |
0.020 0 |
0.100 0 |
0.200 0 |
|
pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度 。(填“增大”、“减小”或“不变”)
实验三探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案
。
 (10分)已知在pH为4-5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净CuSO4 溶液的方法来测定铜的相对原子质量。其实验过程如图所示:
(10分)已知在pH为4-5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净CuSO4 溶液的方法来测定铜的相对原子质量。其实验过程如图所示: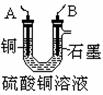 (1)步骤①所加的A的化学式为
;加入A的作用是
_____________ ___ _
__
___。
(1)步骤①所加的A的化学式为
;加入A的作用是
_____________ ___ _
__
___。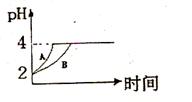 (1) 常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)
(1) 常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)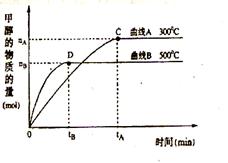 (2) 在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g)
。反应达到平衡时,平衡常数表达式K= ,升高温度,K值
(2) 在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g)
。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 Mg 2+ (aq) + 2OH
- ( aq),某温度下Ksp =
c (Mg 2+) [ c (OH - ) ]2 = 2×10 -11。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。若该温度下某Mg SO4溶液里c(Mg 2+)
=0.002 mol·L-1,如果生成Mg (OH)2沉淀,应调整溶液pH,使之大于 ;该温度下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3. H2O)=2×10-5,, 试计算 (填有或无)Mg(OH)2沉淀生成?
Mg 2+ (aq) + 2OH
- ( aq),某温度下Ksp =
c (Mg 2+) [ c (OH - ) ]2 = 2×10 -11。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。若该温度下某Mg SO4溶液里c(Mg 2+)
=0.002 mol·L-1,如果生成Mg (OH)2沉淀,应调整溶液pH,使之大于 ;该温度下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3. H2O)=2×10-5,, 试计算 (填有或无)Mg(OH)2沉淀生成? 2K2CO3+6H2O
2K2CO3+6H2O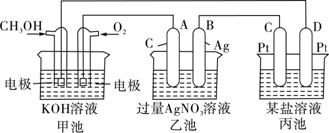
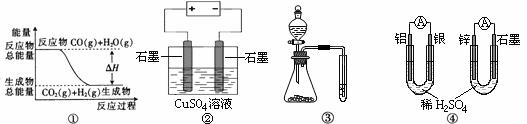
 CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0  溶液的浓度,用酚酞作指示剂,下列操作可能使测定结果偏低的是( )
溶液的浓度,用酚酞作指示剂,下列操作可能使测定结果偏低的是( )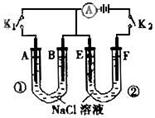 7.如右图所示,A、F为石墨电极,B、E为铁片电极。则下列有关推断错误的是(
)
7.如右图所示,A、F为石墨电极,B、E为铁片电极。则下列有关推断错误的是(
)