24.(9分)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、
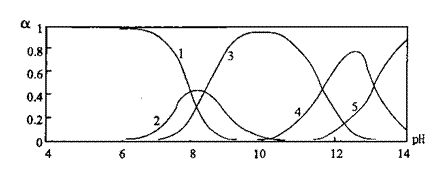 Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-]
(1)Pb(NO3)2溶液中,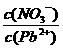 2(填“>”、“=”或“<”=,往该溶液中滴入硫酸铵溶液后,
2(填“>”、“=”或“<”=,往该溶液中滴入硫酸铵溶液后,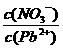 增加,其原因是
;
增加,其原因是
;
(2)往Pb(NO3)2溶液中加入NaOH溶液,pH=9时,主要反应的离子方程式为 ,pH=12时,溶液中存在的阴离子(除NO3-、OH-外)为 ;
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验测得铅离子及相关离子浓度变化如下表:
|
离子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
|
处理前浓度/(mg·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
|
处理后浓度/(mg·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是 ;
 (4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+
E2Pb(s)+2H+,则脱铅的最合适pH范围为 (填代号)。
A.4~5 B.6~7 C.9~10 D.11~12
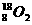 气体,不久前在兰州近代物理研究所制备成功。1mol
气体,不久前在兰州近代物理研究所制备成功。1mol (9分)在一个容积固定的反应容器中有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应:
(9分)在一个容积固定的反应容器中有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应: