27. (10分)
(1)原子数相同、电子总数相同的分子,互称为等电子体,CO与N2互为等电子体。
①CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。根据下表数据,说明CO比N2活泼的原因是
|
|
|
A-B |
A=B |
A≡B |
|
CO |
键能(kJ/mol) |
357.7 |
798.9 |
1071.9 |
|
键能差值(kJ/mol) |
441.2
273 |
|||
|
N2 |
键能(kJ/mol) |
154.8 |
418.4 |
941.7 |
|
键能差值(kJ/mol) |
263.6
523.3 |
②Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。Ni原子的价电子排布式为 。Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型);Fe(CO)5是配合物,配体是__________ 。
(2)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)
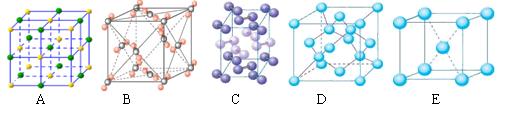
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
 (4)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:
。
(4)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:
。
(5).正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图).下列有关说法正确的是
A.正硼酸晶体属于原子晶体
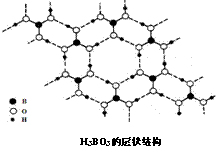 B.H3BO3分子的稳定性与氢键有关
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e-稳定结构
D.含1molH3BO3的晶体中有3mol氢键
潮南区08-09学年度第一学期期末高三级质检
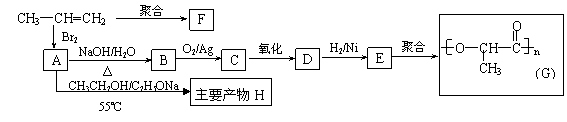
22(10分)在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g) 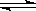 CO(g) + H2O(g)
CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为: ; (2) 该反应的正反应为 反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g)  CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
|
时间/min |
CO2
(mol/L) |
H2
(mol/L) |
CO
(mol/L) |
H2
O ( mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
计算:3min-4min达到平衡时CO的平衡浓度c3和CO2(g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。
23(10分)以下是25℃时几种难溶电解质的溶解度:
|
难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
① 为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
② 为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③ 为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为_______________(填化学式)而除去。
(2)①中加入的试剂应该选择_________为宜,其原因是_____________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为__________________________________。
(4)下列与方案③相关的叙述中,正确的是__________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
24(11分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下所示的表格,表中内容为该族元素的部分性质。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
452 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是 ;
(2)碲的化合价可能有 ;
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱顺序是 (填化学式);
(4)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为 ;
 (5)已知在常温下,生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:
(5)已知在常温下,生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:
(6)右图所示为氧族元素单质与H2反应过程中的能量
变化示意图,其中a、b、c、d分别表示氧族中某一元素
的单质,△H为相同物质的量的单质与H2反应的反应热。
则:b代表 ,d代表 (均写单质名称)。
 B.
B.
 D.
D.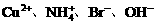
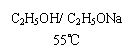
 (ⅰ)CH3CHCH3 --------→CH3CH==CH2 +
(CH3)2CHOC2H5+HBr
(ⅰ)CH3CHCH3 --------→CH3CH==CH2 +
(CH3)2CHOC2H5+HBr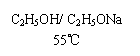
 (ⅱ)CH3CH2CHCH3------→ CH3CH==CHCH3+
CH3CH2CH==CH2+HX
(ⅱ)CH3CH2CHCH3------→ CH3CH==CHCH3+
CH3CH2CH==CH2+HX
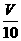 mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。