2.(14分)
(1)冷凝、回流(1+1分)。防止倒吸(2分)。
|
(2)S+2H2SO4(浓) 3SO2↑+2H2O(2分,无加热符号、气体符号扣1分)
(3)取样后,向其中加入氯氧化钠溶液,观察是否有沉淀生成。(或者加热、加盐酸检验SO2气体等方法,开放题,正确即可)(2分)
(4)CuO、CuS、Cu2S(或CuO、CuS可CuO、Cu2S)(2分)
(5)铜与浓硫酸反应的实验中硫酸过量使溶液呈酸性(2分)。取稀释后的溶液适量于试管中,加入足量的铁粉,若有无色无味的气体产生,证明硫酸过量(开放题,正确即可)
6.(11分)新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成__________________________________________________________________________________________________________________________ 。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
|
提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
|
氯水中何种物质能使湿润的红色布褪色? |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
①_____________ ____________ 。 ②_____________ ____________ 。 ③____________ _____________ 。 ④ H2O使布条褪色 |
实验1:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验2:_______________ ______________。 实验3:把红色布条放在水里,布条不褪色。 |
__________ __________ __________ |
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3  HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3) =
4.45×10-7
HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3) =
4.45×10-7
HCO3- CO32- + H+
Ka2(H2CO3) = c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
CO32- + H+
Ka2(H2CO3) = c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
HClO  H+ + ClO- Ka(HClO)
= 2.95×10-8
H+ + ClO- Ka(HClO)
= 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中_________________________ ;
②氯气和碳酸钠按照1∶1的比例恰好反应_______________________;
③将过量的氯气通入到少量的碳酸钠溶液___________________。
2008届高三化学实验题练习

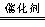 N2+2CO2 NO
②-1160 kJ·mol-1
N2+2CO2 NO
②-1160 kJ·mol-1 Fe2O3+3H2O
Fe2O3+3H2O (12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O
(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O 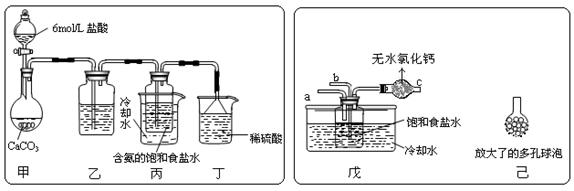
 (Ⅰ)乙装置中的试剂是 ; (Ⅱ)丁装置中稀硫酸的作用是
;
(Ⅰ)乙装置中的试剂是 ; (Ⅱ)丁装置中稀硫酸的作用是
; (1)某校化学研究性学习小组的同学在技术人员的指导下,按下列
(1)某校化学研究性学习小组的同学在技术人员的指导下,按下列
 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。