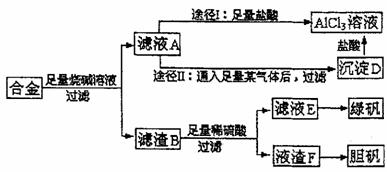
29.(10分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
 |
 |
c |
d |
e |
f |
|
|
g |
|
h |
|
|
|
|
|
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
(2)d元素名称为 ,其基态原子的电子排布式为 。

(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 (填化学式),是 晶体。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,空间构型为 ;序列“2”的氢化物的结构式为 ,其中心原子的杂化轨道类型是 杂化。
26.(12分)金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
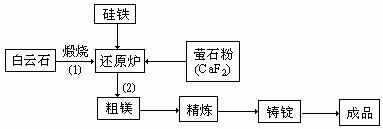
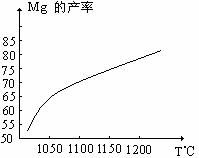
(1)在冶炼过程中反应温度对生成金属镁的影响如图,从图中分析,还原反应的反应热
△H 0(填“<”“>”“=”)理由是 。
(2)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
|
剩余压强mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
(3)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2• 6H2O),其中
KCl•MgCl2• 6H2O属于 。
A.复盐 B.混合物 C.配合物
(4)写出煅烧白云石的反应化学方程式 。
22.(11分)新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2,请设计实验证明有O2生成。
。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
|
提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
|
氯水中何种物质能使湿润的红色布条褪色 |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
①
② ③ ④H2O使布条褪色 |
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色 实验②: 实验③: 实验④:把红色布条放在水里布条不褪色 |
|
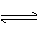 (3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
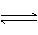 H2CO3
HCO3-+ H+
Ka1(H2CO3)=4.45×10-7
H2CO3
HCO3-+ H+
Ka1(H2CO3)=4.45×10-7
 HCO3-
CO32-+H+
Ka2(HCO3-)=5.61×10-11
HCO3-
CO32-+H+
Ka2(HCO3-)=5.61×10-11
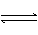
HClO H++ClO- Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中;
②氯气和碳酸钠按照1:1的比例恰好反应;
③将过量的氯气通入到少量的碳酸钠溶液中。
。
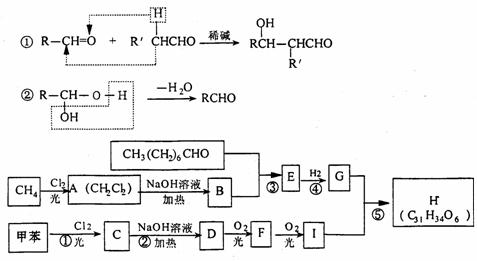
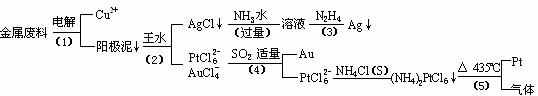
 ;
;