网址:http://m.1010jiajiao.com/timu3_id_37637[举报]
A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大。A原子无中子, B、G原子的最外层电子数均为其电子层数的两倍,D、G元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应(相对分子质量甲< 乙)转化关系如图(反应条件略去),原子E最外层电子数和其电子层数相等。元素F形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:

(1)A2D的熔沸点比A2G高的原因是 。B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 。
(2)E4B3和水反应的化学方程式 。
(3)写出M与甲的浓溶液加热时反应的化学方程式 。
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(5)已知CH4 (g)+ 2O2 (g)=CO2 (g)+2H2O (l) △H1=a kJ/mol
欲计算反应CH4 (g)+ 4NO (g)=2N2 (g)+CO2 (g)+2H2O (l)的焓变△H2 , 则还需要查找某化合反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时 △H3 = b kJ/mol,则该反应的热化学方程式为 。
据此计算出△H2 = kJ/mol(用含a和b的式子表示)。
查看习题详情和答案>>
A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大。A原子无中子, B、G原子的最外层电子数均为其电子层数的两倍,D、G元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应(相对分子质量甲< 乙)转化关系如图(反应条件略去),原子E最外层电子数和其电子层数相等。元素F形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题: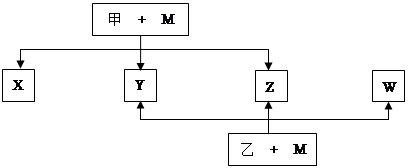
(1)A2D的熔沸点比A2G高的原因是 。B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 。
(2)E4B3和水反应的化学方程式 。
(3)写出M与甲的浓溶液加热时反应的化学方程式 。
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(5)已知CH4 (g)+ 2O2(g)=CO2 (g)+2H2O(l) △H1=a kJ/mol
欲计算反应CH4 (g)+ 4NO (g)=2N2 (g)+CO2 (g)+2H2O(l)的焓变△H2 ,则还需要查找某化合反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时 △H3 =" b" kJ/mol,则该反应的热化学方程式为 。
据此计算出△H2 = kJ/mol(用含a和b的式子表示)。

(1)A2D的熔沸点比A2G高的原因是 。B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 。
(2)E4B3和水反应的化学方程式 。
(3)写出M与甲的浓溶液加热时反应的化学方程式 。
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(5)已知CH4 (g)+ 2O2(g)=CO2 (g)+2H2O(l) △H1=a kJ/mol
欲计算反应CH4 (g)+ 4NO (g)=2N2 (g)+CO2 (g)+2H2O(l)的焓变△H2 ,则还需要查找某化合反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时 △H3 =" b" kJ/mol,则该反应的热化学方程式为 。
据此计算出△H2 = kJ/mol(用含a和b的式子表示)。
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D、E、F为同一周期,A与D,C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)写出F在周期表中的位置________。画出D的离子结构示意图___________。
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为_______________。1gA的单质与C的单质完全反应生成Y(Y为液态),放出142.9KJ的热量,请写出该反应的热化学方程式_______________________。
(3)C与F形成的常见化合物属于_________晶体。若E的单质是常见的半导体材料,则A与B形成的常见化合物R、C与D形成的常见化合物S、C与E 形成的常见化合物T, R、S、T三者的沸点从高到低排列为___________________________(写化学式)。
(4)画出B单质的结构式_______________。最近科学家合成出了B元素形成的B![]() 电子式
电子式, 则n值为___ 。
(5)A的单质与C的单质在KOH的溶液中可以形成原电池,已知M、N均为碳电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则N极的电极反应式为____________________________________。
(6)在10L的密闭容器中,通入2molFC2气体和3mol C的气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21mol·L—1,则平衡时FC2的转化率为________。
查看习题详情和答案>>
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D、E、F为同一周期,A与D,C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)写出F在周期表中的位置________。画出D的离子结构示意图___________。
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为_______________。1gA的单质与C的单质完全反应生成Y(Y为液态),放出142.9KJ的热量,请写出该反应的热化学方程式_______________________。
(3)C与F形成的常见化合物属于_________晶体。若E的单质是常见的半导体材料,则A与B形成的常见化合物R、C与D形成的常见化合物S、C与E 形成的常见化合物T, R、S、T三者的沸点从高到低排列为___________________________(写化学式)。
(4)画出B单质的结构式_______________。最近科学家合成出了B元素形成的B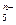 电子式
电子式 ,则n值为___ 。
,则n值为___ 。
(5)A的单质与C的单质在KOH的溶液中可以形成原电池,已知M、N均为碳电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则N极的电极反应式为____________________________________。
(6)在10L的密闭容器中,通入2molFC2气体和3mol C的气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol·L—1,则平衡时FC2的转化率为________。