摘要:22.已知C.D.F.I均为常见气体.E为常见金属.G溶液蒸干并灼热得红棕色粉末H.I是一种能导致温室效应的气体.B由三种元素组成三它们有如下框图关系: 试回答下列问题 (1)反应①阳极的电极反应式 . (2)反应③的化学方程式 . (3)反应④的审子方程式 . (4)反应②蒸发至于并灼烧最终得H而不是无水的G.试用文字和方程式简述其理由: . (5)已知B的结构为三角双锥.图中○代表F分子.●代表E原子. 写出B的化学式 .
网址:http://m.1010jiajiao.com/timu3_id_37633[举报]
图甲中A-J均为中学化学中常见的物质,A、H是短周期元素组成的常见气体单质,B是日常生活常见金属,它们之间有如下转化关系(反应中生成的水及部分生成物已略去).请回答以下问题:
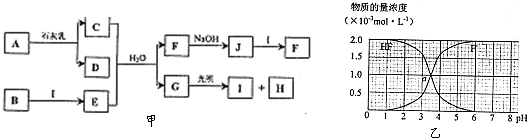
(1)D的电子式是 ,G的结构式是 ;
(2)C的水溶液显 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示);
(3)写出J+I→F的离子方程式: ;
(4)在298K,100kPa时,在1L水中可溶解0.09mol A,实验测得溶于水的A约有
与水反应,请估算该离子反应的平衡常数K= ;(忽略溶液体积变化)
(5)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到(HF)、c(F-)与溶液pH的变化关系如图乙.若将4.0×10-3mol?L-1HF溶液与4.0×10-3mol?L-1CaCl2溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10].
查看习题详情和答案>>

(1)D的电子式是
(2)C的水溶液显
(3)写出J+I→F的离子方程式:
(4)在298K,100kPa时,在1L水中可溶解0.09mol A,实验测得溶于水的A约有
| 1 | 3 |
(5)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到(HF)、c(F-)与溶液pH的变化关系如图乙.若将4.0×10-3mol?L-1HF溶液与4.0×10-3mol?L-1CaCl2溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10].
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.I单质与NaOH溶液反应产生可燃性气体.
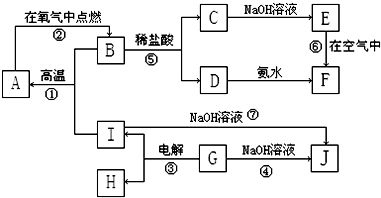
请填写下列空白:
(1)I、G、J三种物质中所含同一种元素在周期表中位置
(2)写出反应⑥的化学方程式
(3)写出反应⑦的化学方程式
(4)若28g A单质在足量的氧气中灼烧,反应放出的热量为Q kJ(Q>0),写出这个反应的热化学方程式:
(5)反应⑦中若有18g I参与反应,则转移电子数为
查看习题详情和答案>>

请填写下列空白:
(1)I、G、J三种物质中所含同一种元素在周期表中位置
第3周期、第IIIA族
第3周期、第IIIA族
;(周期和族)(2)写出反应⑥的化学方程式
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
;(3)写出反应⑦的化学方程式
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
;(4)若28g A单质在足量的氧气中灼烧,反应放出的热量为Q kJ(Q>0),写出这个反应的热化学方程式:
3Fe(s)+2O2(g)=Fe3O4(s);△H=-6QkJ?mol-1
3Fe(s)+2O2(g)=Fe3O4(s);△H=-6QkJ?mol-1
;(5)反应⑦中若有18g I参与反应,则转移电子数为
2
2
NA.I.A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图1所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
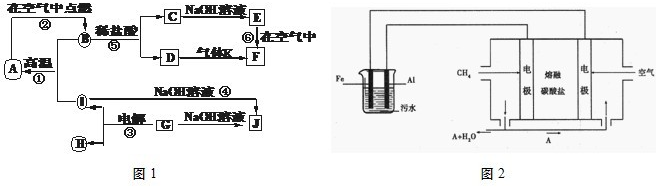
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置______,
(2)写出反应④的离子方程式______.
(3)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH______7(填“>”、“<”或“=”),用离子方程式表示其原因:______.
II.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图2所示.
(1)电解池阳极的电极反应分别是①______; ②4OH--4e-=2H2O+O2↑.
(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:CH4+4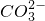 -8e-=5CO2+2H2O
-8e-=5CO2+2H2O
①正极的电极反应是______.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是______.
(3)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)______ L.
查看习题详情和答案>>
I.A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图1所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
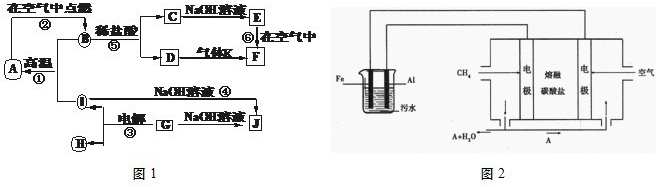
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置______,
(2)写出反应④的离子方程式______.
(3)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH______7(填“>”、“<”或“=”),用离子方程式表示其原因:______.
II.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图2所示.
(1)电解池阳极的电极反应分别是①______; ②4OH--4e-=2H2O+O2↑.
(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:CH4+4
-8e-=5CO2+2H2O
①正极的电极反应是______.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是______.
(3)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)______ L.
查看习题详情和答案>>

(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置______,
(2)写出反应④的离子方程式______.
(3)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH______7(填“>”、“<”或“=”),用离子方程式表示其原因:______.
II.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图2所示.
(1)电解池阳极的电极反应分别是①______; ②4OH--4e-=2H2O+O2↑.
(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:CH4+4
| CO | 2-3 |
①正极的电极反应是______.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是______.
(3)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)______ L.
I.A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图1所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
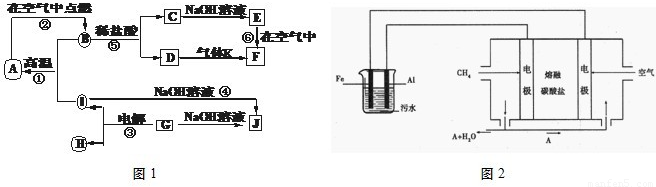
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置______,
(2)写出反应④的离子方程式______.
(3)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH______7(填“>”、“<”或“=”),用离子方程式表示其原因:______.
II.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图2所示.
(1)电解池阳极的电极反应分别是①______; ②4OH--4e-=2H2O+O2↑.
(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:CH4+4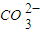 -8e-=5CO2+2H2O
-8e-=5CO2+2H2O
①正极的电极反应是______.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是______.
(3)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)______ L.
查看习题详情和答案>>

(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置______,
(2)写出反应④的离子方程式______.
(3)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH______7(填“>”、“<”或“=”),用离子方程式表示其原因:______.
II.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图2所示.
(1)电解池阳极的电极反应分别是①______; ②4OH--4e-=2H2O+O2↑.
(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:CH4+4
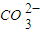 -8e-=5CO2+2H2O
-8e-=5CO2+2H2O①正极的电极反应是______.
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是______.
(3)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)______ L.
查看习题详情和答案>>