25.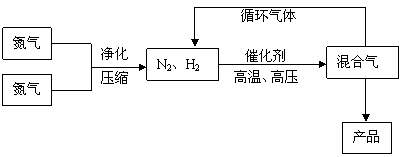 (10分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)
(10分)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),△H
= -92.44kJ/mol;其部分工艺流程如下:
2NH3(g),△H
= -92.44kJ/mol;其部分工艺流程如下:
反应体系中各组分的部分性质见下表:
|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度的升高,K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
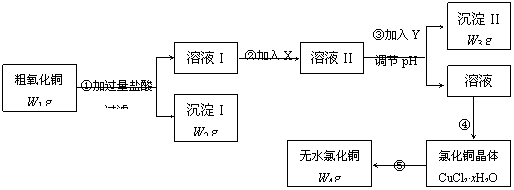
22.(15分)某化学研究性学习小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜并测定样品中氧化铜的质量分数,其实验流程如下:

实验过程中的pH调节可参考下表:
|
物质 |
开始沉淀时的pH |
完全沉淀时的pH |
|
氢氧化铁 |
2.7 |
3.7 |
|
氢氧化亚铁 |
7.6 |
9.6 |
|
氢氧化铜 |
5.2 |
6.4 |
回答以下问题:
(1)步骤①过滤操作中所用仪器有铁架台(带铁圈)、漏斗、烧杯等,还需要使用的仪器用品有 。
(2)步骤①中发生的离子反应方程式 。
(3)步骤②溶液I中加入X的目的是 。
(4)试剂Y可选用(填字母) ,选择的原因是
。
a.氢氧化钠 b.氨水 c.碱式碳酸铜 d.氧化铜
(5)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2·xH2O,其原因是
。
(6) 经检测,CuCl2·xH2O中含水28.6%,则CuCl2·xH2O中x的值为 。
(7)若步骤④中有80% 的氯化铜转入晶体,其余各步转化都是完全的,请根据流程图中表示的质量数据,写出样品中氧化铜的质量分数计算式 。
16.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
X |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A. 离子半径大小:r(M3+)>r(T2-)
B. R的氧化物对应的水化物可能具有两性
C. X单质可在氧气燃烧生成XO3
D. L、X形成的简单离子核外电子数相等
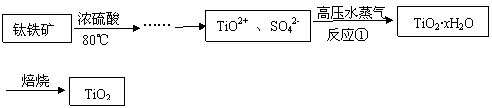
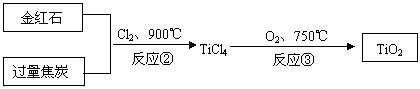
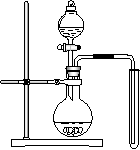 (2)可用右图装置制备并收集一试管二氧化氮,
(2)可用右图装置制备并收集一试管二氧化氮,  (3)将装有二氧化氮的试管A倒插入水中(图I),并轻轻晃动试管,观察到的现象是:
(3)将装有二氧化氮的试管A倒插入水中(图I),并轻轻晃动试管,观察到的现象是: ①画出制取O2装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明所用试剂。
①画出制取O2装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明所用试剂。