摘要:17.⑴第三周期第VIA族 ⑵C3N4 ⑶2Al+2OH-+2H2O=2AlO2-+3H2↑
网址:http://m.1010jiajiao.com/timu3_id_370430[举报]
(2010?临沂一模)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐;A元素与C元素可形成两种液态化合物,其原子个数比分别为1:1和2:1,分子中电子总数分别为18和10;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.
(1)写出D元素的原子结构示意图
 ;E元素在周期表中位置
;E元素在周期表中位置
(2)C和E两种元素相比较,非金属性较强的是(填元素符号)
A.比较这两种元素的常见单质的沸点 B.比较这两种元素的单质与氢气化合的难易 C.比较这两种元素的气态氢化物的稳定性
(3)写出D的氢氧化物在水中发生酸式电离的电离方程式:
(4)B元素与C元素形成的化合物中,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的B的含氧酸盐的化学式是
查看习题详情和答案>>
(1)写出D元素的原子结构示意图


第三周期第VIA族
第三周期第VIA族
;(2)C和E两种元素相比较,非金属性较强的是(填元素符号)
O
O
,可以验证该结论的是BC
BC
;(填写编号)A.比较这两种元素的常见单质的沸点 B.比较这两种元素的单质与氢气化合的难易 C.比较这两种元素的气态氢化物的稳定性
(3)写出D的氢氧化物在水中发生酸式电离的电离方程式:
Al(OH)3 AlO2-+H++H2O
AlO2-+H++H2O
 AlO2-+H++H2O
AlO2-+H++H2OAl(OH)3 AlO2-+H++H2O
AlO2-+H++H2O
,欲使上述体系中D的简单阳离子浓度增加,可加入的物质是 AlO2-+H++H2O
AlO2-+H++H2O盐酸(稀硫酸也可以)
盐酸(稀硫酸也可以)
;(4)B元素与C元素形成的化合物中,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的B的含氧酸盐的化学式是
NaNO2
NaNO2
.(2009?肇庆二模)W、X、Y、Z为同一短周期元素,原子序数依次增大.已知W、Y、Z三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水.下列判断正确的是( )
查看习题详情和答案>>
aX、bY、cZ、dW、eQ为五种原子序数依次增大的短周期元素,Z为地壳中含量最高的金属元素,W与X、Q相邻,W与X具有相同的价电子数,d=2a,3b=d+e.W与Y形成的化合物A的浓溶液在空气中长期放置发生反应,生成物之一B与X与Y1:1组成的化合物C的结构和化学性质相似,其溶液显黄色.回答下列问题:
(1)W元素在周期表中的位置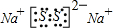
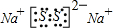
(2)Q的单质与Y与W形成化合物的溶液反应,有浅黄色沉淀生成,用离子方程式表示原因
(3)W离子与Z离子在溶液中
(4)写出制取Z的化学方程式:
(5)Z与P原子形成P4Z3分子中各原子最外层均已达8电子结构,则一个P4Z3分子中含有共价键总数为
查看习题详情和答案>>
(1)W元素在周期表中的位置
第三周期第VIA族
第三周期第VIA族
化合物B的电子式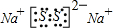
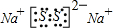
(2)Q的单质与Y与W形成化合物的溶液反应,有浅黄色沉淀生成,用离子方程式表示原因
Cl2+S2-═2Cl-+S↓
Cl2+S2-═2Cl-+S↓
.反应后溶液的pH减小
减小
(填“增大”、“不变”或“减小”)(3)W离子与Z离子在溶液中
不能
不能
共存(填能、不能).请用化学用语简要说明原因2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑.
2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑.
(4)写出制取Z的化学方程式:
2Al2O3
4Al+3O2↑
| ||
2Al2O3
4Al+3O2↑
.
| ||
(5)Z与P原子形成P4Z3分子中各原子最外层均已达8电子结构,则一个P4Z3分子中含有共价键总数为
12
12
个.