21. (10分)
(10分)
问题1:
问题2:
|
序号 |
实际生产中采取的措施 |
工业生产实例(写名称) |
|
(1) |
通过增大压强提高原料转化率 |
|
|
(2) |
使用催化剂增大反应的速率 |
|
问题3:化学反应中均伴随着能量的变化。如果一个化学
反应中,反应物的总能量和生成物的总能量有如图所示的
关系,则该反应过程中的能量变化是 。
热量的比是 (保留1位小数)。
问题4:反应物相同,反应物的浓度不同,
反应的原理不同: 。
24.(8分)2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+ Fe2++ H+= Mn2++ Fe3++ H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)
的质量为 g。
(4)混合物中Cu2S的质量分数为 。
|
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量/g |
12.60 |
18.90 |
28.00 |
|
二氧化硫的体积/L |
1.12 |
1.68 |
2.24 |
|
硫的质量/g |
1.28 |
1.92 |
2.56 |
(1)样品与硫酸可能发生反应的离子方程式为 。
(2)根据上表数据分析,该样品 (填选项字母)
A.只含有Na2S2O3
B.含有Na2S2O3和Na2SO3两种成分
C.含有Na2S2O3、Na2SO3和Na2SO4三种成分
(3)试计算:该样品中各成分的物质的量之比。
(4)求所加硫酸溶液的物质的量浓度是多少?
(5)若将63 g该样品与一定量的该硫酸溶液微热,欲计算生成SO2的体积,还需要提供的一个数据是(用a表示该数值,并注明单位) 。
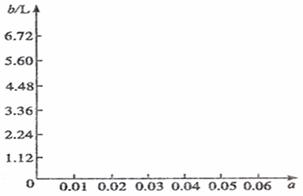 试讨论:当a在不同取值范围时,SO2的体积b.并请在图上画出b随a变化的曲线。
试讨论:当a在不同取值范围时,SO2的体积b.并请在图上画出b随a变化的曲线。
高三年级第一次月考化学试题答题纸
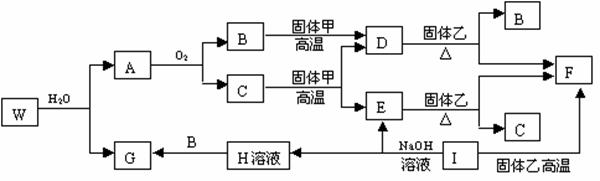

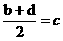 ,③
,③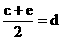 ,请根据提供的信息,回答下列问题(回答问题时,必须用具体元素符号代替A、B、C、D、E、G):
,请根据提供的信息,回答下列问题(回答问题时,必须用具体元素符号代替A、B、C、D、E、G):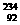 U、
U、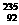 U、
U、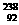 U,其中
U,其中