4.硫酸工业生产应考虑综合经济效益。
(1)若从下列四个地区选址新建一座硫酸厂,最合适的地点应在_________附近。
a.风景旅游区 b.硫酸消耗中心区 c.人口稠密区 d.黄铁矿矿区
 (2)工业生产硫酸的原料气成分(体积分数)为:SO2 7%,O2 11%,N2 82%。
(2)工业生产硫酸的原料气成分(体积分数)为:SO2 7%,O2 11%,N2 82%。
压强及温度对SO2转化率的影响如下:
|
|
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是
_____________________________________________________。
分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是___________________________________________________________。
(3)据测算,接触法制硫酸过程中,每生产1 t 98%的硫酸需消耗3.60×105 kJ能量。
 若反应:2SO2(g)+O2(g) 2SO3(g),ΔH=-196.6 kJ /mol放出的热量完全被利
若反应:2SO2(g)+O2(g) 2SO3(g),ΔH=-196.6 kJ /mol放出的热量完全被利
用,则每生产1 t 98%的硫酸可为外界提供_____________kJ能量
(不考虑其他过程释放的能量)。
3..硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2-3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度50-80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结品:
④待结晶完毕后,滤出晶体,用少量冰水洗涤品体2-3次,再用滤纸将晶体吸干:
⑤将制得的:FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是__________,加热的作用是__________。
(2)实验步骤②明显不合理,理由是____________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是___________:__________。
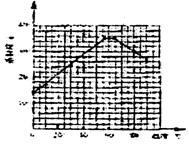
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
|
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
|
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
 (5)若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制
(5)若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制
的结晶温度(t)的范围为__________。
3答案.(1)除油污 升高温度,溶液碱性增强,去油污能力增强 (2分)
(2)应该铁悄过量(或反应后溶液中必须有铁剩余)否则溶液中可能有Fe3+存在(3分)
 (3)洗涤除去晶体表面附着的硫酸等杂质用冰水洗涤可降低洗涤过程中FeSO4·7HZO的损耗(2分)
(3)洗涤除去晶体表面附着的硫酸等杂质用冰水洗涤可降低洗涤过程中FeSO4·7HZO的损耗(2分)
 N2+3Cu+3H2O请回答:
N2+3Cu+3H2O请回答: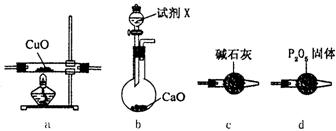
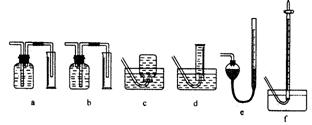
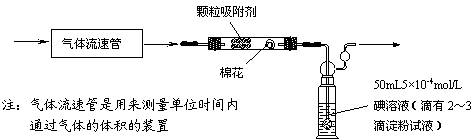 ⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置: ①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准。