|
质量已知),其反应方程式为:3CuO+2NH3 = 3Cu+N2↑+3H2O,下图为该实验的装置图,其中量N2体积的装置E是由甲、乙两根玻璃管组成的,它们用橡皮管连通,并装入适量水,甲管有刻度,供量气用,乙管可上下移动,以调节液面高度。
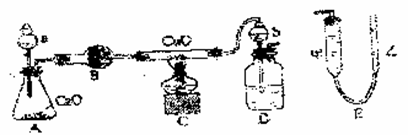
请回答以下问题:
(1)试剂a的名称为 ,锥形瓶内发生的化学反应方程式为 。
(2)装置D中b仪器的作用是 。
(3)实验开始时,在检验装置的气密性之后,必须首先 ,然后 ,再点燃C处酒精灯。
(4)反应前玻璃管和CuO总质量为m1g,反应结束后玻璃管和剩余固体质量为m2g,甲管量得气体体积为nL(标准状况),则氧的相对原子质量为 。
(5)为了较准确地测量N2体积,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意 (填字母)。
A、视线与凹液面最低处相平
B、等待片刻,待乙管中液面不再上升时,立刻读数
C、读数时应上下移动乙管,使甲、乙两管中液面相平
D、读数时要注意室内温度和气压
(6)下列操作可能造成测定结果偏高的是 (填字母)。
A、加热前未排尽系统内的空气 B、玻璃管内的CuO有剩余
C、将D处浓H2SO4换成水 D、读甲管终点视数时,俯视甲管内液面
23、14gCu、Ag合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况)O2混合,恰好被水全部吸收生成硝酸,则金属中Cu的质量为
A、1.6g B、3.2g C、6.4g D、9.6g
 (4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为
。
(4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为
。 工业上用以合成氨的原料之一 --氢气,有一种来源是取自石油气。例如丙
工业上用以合成氨的原料之一 --氢气,有一种来源是取自石油气。例如丙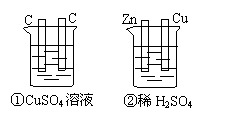 A、1 B、2 C、3 D、4
A、1 B、2 C、3 D、4