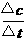0 35891 35899 35905 35909 35915 35917 35921 35927 35929 35935 35941 35945 35947 35951 35957 35959 35965 35969 35971 35975 35977 35981 35983 35985 35986 35987 35989 35990 35991 35993 35995 35999 36001 36005 36007 36011 36017 36019 36025 36029 36031 36035 36041 36047 36049 36055 36059 36061 36067 36071 36077 36085 447348
 净化
净化 2NH3(g)+92.4KJ
2NH3(g)+92.4KJ 体积缩小
体积缩小 =
=