24.(10分)2,4,5-三氯苯酚和氯乙酸反应可制得除草剂2,4,5-三氯苯氧乙酸。某生
产该除草剂的工厂在一次事故中泄漏出一种二恶英,简称为
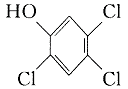 TCDD。有关物质的结构式如下:
TCDD。有关物质的结构式如下:
三氯苯酚 氯乙酸Cl-CH2COOH
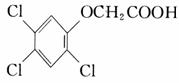
请写出:
|
反应的化学方程式:
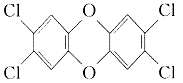
(2)(4分)2,4,5-三氯苯酚生成TCDD
反应的化学方程式 。
24.(10分)2,4,5-三氯苯酚和氯乙酸反应可制得除草剂2,4,5-三氯苯氧乙酸。某生
产该除草剂的工厂在一次事故中泄漏出一种二恶英,简称为
 TCDD。有关物质的结构式如下:
TCDD。有关物质的结构式如下:
三氯苯酚 氯乙酸Cl-CH2COOH

请写出:
|
反应的化学方程式:

(2)(4分)2,4,5-三氯苯酚生成TCDD
反应的化学方程式 。