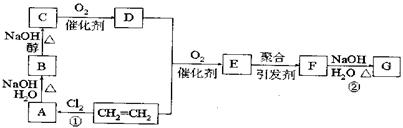
25.(12)以石油产品乙烯为超始原料进行合成高分子化合物F和G,下图所示为合成路线图:
|
 CH2=CH2+CH3COOH
C4H6O2(醋酸乙烯酯)
CH2=CH2+CH3COOH
C4H6O2(醋酸乙烯酯)
|
|
|
 CH3CH2Cl
CH2==CH2+HCl
CH3CH2Cl
CH2==CH2+HCl
|
 CH3CH2Cl+H2O
CH3CH2OH+HCl
CH3CH2Cl+H2O
CH3CH2OH+HCl
又知:与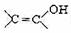 结构相似的有机物不稳定,发生分子重排生成
结构相似的有机物不稳定,发生分子重排生成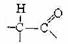
请回答下列问题:
(1)写出结构简式:E: F:
(2)反应①、②反应类型:① ②
(3)写出A→B、B→C的化学方程式:
A→B: B→C:
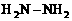 )和甲胺(
)和甲胺(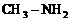 )都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):
。
)都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):
。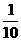 ,用
,用 mol·L-1 NaOH溶液滴定恰好用去
mol·L-1 NaOH溶液滴定恰好用去 ml。
ml。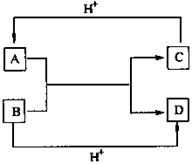 问题g:此方案中不需要的数据是
A CV B
问题g:此方案中不需要的数据是
A CV B 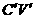 C
C  D m
D m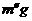 备用,
备用,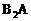 分子中的电子数相同、Y分子中的电子数为18,A,B,D形成离子化合物,其化学式为
分子中的电子数相同、Y分子中的电子数为18,A,B,D形成离子化合物,其化学式为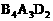 ,其水溶液呈弱酸性;请回答:
,其水溶液呈弱酸性;请回答: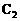 和X(过量)反应
。
和X(过量)反应
。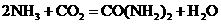 ,已知下列物质在一定条件下均能与水反应产生
,已知下列物质在一定条件下均能与水反应产生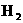 和
和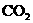 ,
,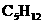 、
、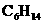 ) (B)
) (B)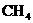 (C)CO (D)碳
(C)CO (D)碳