0 35365 35373 35379 35383 35389 35391 35395 35401 35403 35409 35415 35419 35421 35425 35431 35433 35439 35443 35445 35449 35451 35455 35457 35459 35460 35461 35463 35464 35465 35467 35469 35473 35475 35479 35481 35485 35491 35493 35499 35503 35505 35509 35515 35521 35523 35529 35533 35535 35541 35545 35551 35559 447348
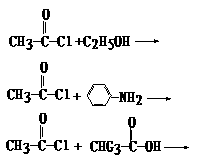
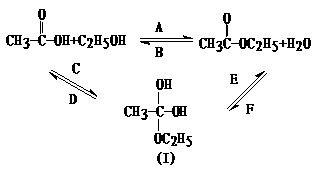 (8分)乙酸跟乙醇在浓硫酸存在并加热和条件下发生的酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(Ⅰ)这一步
(8分)乙酸跟乙醇在浓硫酸存在并加热和条件下发生的酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(Ⅰ)这一步
 ⑵(3分)如果使原料C2H5OH,用
⑵(3分)如果使原料C2H5OH,用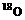 标记,则生成物乙酸乙酯中是否有
标记,则生成物乙酸乙酯中是否有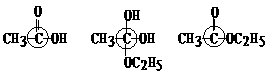
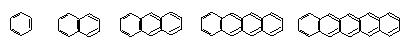 (11分)下面是苯和一组稠环芳香烃的结构式
(11分)下面是苯和一组稠环芳香烃的结构式 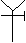



 玻璃导管
(但应标示出在液面上或液面下)
玻璃导管
(但应标示出在液面上或液面下) 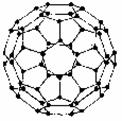
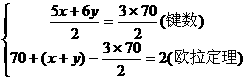 解得五边形的数目x=12,六边形的数目y=25
解得五边形的数目x=12,六边形的数目y=25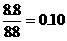 摩尔
(1)共生成H2S0.10摩尔,在溶液中溶解的物质的量为0.10×0.20=0.02摩尔,所以收集到H2S气体的物质的量=0.10-0.02=0.08摩尔,换算成体积=22.4×0.08=1.8升。
(2)生成Fe2+0.10摩尔,其浓度为
摩尔
(1)共生成H2S0.10摩尔,在溶液中溶解的物质的量为0.10×0.20=0.02摩尔,所以收集到H2S气体的物质的量=0.10-0.02=0.08摩尔,换算成体积=22.4×0.08=1.8升。
(2)生成Fe2+0.10摩尔,其浓度为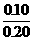 =0.5摩/升,消耗掉H+的物质的量为0.20摩尔。反应前H+的物质的量为2.0×0.2=0.4摩尔,故H+最后的浓度为
=0.5摩/升,消耗掉H+的物质的量为0.20摩尔。反应前H+的物质的量为2.0×0.2=0.4摩尔,故H+最后的浓度为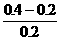 =1.0摩/升。
=1.0摩/升。