摘要:物质的量物理意义:衡量宏观物质的质量和微观粒子数量的物理量.它是七个国际 单位制物理量中的一个(质量.长度.时间.电流强度.热力学温度.光学强度).其单位是摩尔.
网址:http://m.1010jiajiao.com/timu3_id_355097[举报]
19世纪丹麦学者尤利乌斯?托姆森得到一个计算CuCI2?2H2O在水中溶解热效应(△H)的式子,当所得溶液中每1 mol CuCl2有x mol水时,所产生的热效应△H=[3. 35一21. 02× (x一10)/( x+11.24) ]kJ (△H<0,表明反应放热,△H>0,表明反应吸热![]() 。2 0 °C时(此时饱和溶液中每l00 g水含无水氯化铜74. 5g), 每摩尔氯化铜溶解的热效应与
。2 0 °C时(此时饱和溶液中每l00 g水含无水氯化铜74. 5g), 每摩尔氯化铜溶解的热效应与 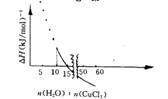 所形成饱和溶液中含水量的关系如下图所示
所形成饱和溶液中含水量的关系如下图所示
x = n(H2O)n(CuCl2)
则下列叙述不正确的是
A.仅根据题目所给信息,无法算出2 0 °C时CuCl2饱和溶液的物质的量浓度
B.CuCl2?2H2O溶于水是放热的
C.在极稀的溶液中,即当x趋向无穷大时,1 mol氯化铜溶解时放出17.67 kJ热量
D.当x<10时,因CuCI2不能完全溶解,上图无物理意义
查看习题详情和答案>>(1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:
(2)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程,
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ?mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ?mol-1
H2(g)+
O2(g)=H2O(l)△H=-285.84kJ?mol-1
完成下列问题:在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
查看习题详情和答案>>
C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(l)△H=-2900mol?L-1
C4H10(g)+13/2O2(g)=4CO2(g)+5H2O(l)△H=-2900mol?L-1
(2)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
1:1
1:1
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程,
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ?mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ?mol-1
H2(g)+
| 1 | 2 |
完成下列问题:在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ?mol-1
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ?mol-1
. 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:(1)如图表示一定温度下,向体积为10L的密闭容器中充入1molO2和一定量的SO2后,SO2和SO3(g)的浓度随时间变化的情况.
①该温度下,从反应开始至平衡时氧气的平均反应速率是
②该温度下,反应2SO2(g)+O2(g)?2SO3(g)的平衡常数为
(2)以黄铜矿(主要成分CuFeS2)为原料,经焙烧、熔炼等使铁元素及其他有关杂进入炉渣,将铜元素还原为铜.发生的主要反应为:
2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ?mol-1
2Cu2O(s)+Cu2S (s)═6Cu(s)+SO2(g)△H=+116.0kJ?mol-1
①“焙烧”时,通入少量空气使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeS,其物质的量比为1:2)和SO2,该反应的化学方程式为:
②在熔炼中,Cu2S与等物质的量的O2反应生成Cu的热化学方程式为:

(3)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容.如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-═SxS2-+2xe-,则阴极的电极反应式是:
②将Na2S?9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解.其原因是(用离子反应方程式表示):
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态).
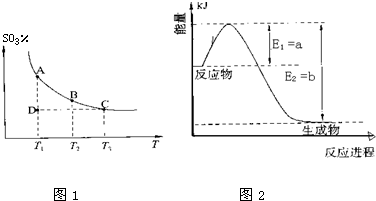
根据图示回答下列问题:
①2SO2(g)+O2(g)?2SO3(g)的△H
②若在恒温、恒容条件下向上述平衡体系中通He,V正
③若在恒温、恒压条件下向上述平衡体系中通入氦气,V正
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①如图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
②工业合成氨的反应为N2(g)+3H2(g)
2NH3(g).在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是
A、增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
③工业合成氨的反应为N2(g)+3H2(g)
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g).反应在一定条件下达到平衡时,NH3的体积分数为
.计算:该条件下N2(g)+3H2(g)
2NH3(g)的平衡常数为
④已知化学反应:N2(g)+3H2(g)?2NH3(g);其化学平衡常数K与温度T的关系如下表:
400℃时,在2L的密闭容器中2NH3(g)?N2(g)+3H2(g) 的化学平衡常数K的值为
查看习题详情和答案>>
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态).

根据图示回答下列问题:
①2SO2(g)+O2(g)?2SO3(g)的△H
<
<
0.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>
>
K2;若反应进行到状态D时,v正>
>
v逆(填“>”、“<”或“=”).②若在恒温、恒容条件下向上述平衡体系中通He,V正
不变
不变
(填“增大”、“减小”或“不变”);平衡不
不
移动(填“向左”、“向右”或“不”).③若在恒温、恒压条件下向上述平衡体系中通入氦气,V正
减小
减小
,V逆减小
减小
;平衡向左
向左
移动.Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①如图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1
(△H的数值用含字母a、b的代数式表示).②工业合成氨的反应为N2(g)+3H2(g)
| ||
| 高温 |
AB
AB
.A、增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
③工业合成氨的反应为N2(g)+3H2(g)
| ||
| 高温 |
| 4 |
| 7 |
| ||
| 高温 |
200
200
;N2的平衡转化率为66.7%
66.7%
.④已知化学反应:N2(g)+3H2(g)?2NH3(g);其化学平衡常数K与温度T的关系如下表:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
2
2
.当测得NH3和N2、H2的物质的量分别为12mol和8mol、4mol时,则该反应的v正(N2)大于
大于
v逆(N2)(填“大于”、“小于”或“等于”)