0 35237 35245 35251 35255 35261 35263 35267 35273 35275 35281 35287 35291 35293 35297 35303 35305 35311 35315 35317 35321 35323 35327 35329 35331 35332 35333 35335 35336 35337 35339 35341 35345 35347 35351 35353 35357 35363 35365 35371 35375 35377 35381 35387 35393 35395 35401 35405 35407 35413 35417 35423 35431 447348



 1、在温度和压强不变时,1L
NO2高温分解,按2NO2 2NO+O2进行,达到平衡时气体体积变为1.2L,则NO2的分解率为( )
1、在温度和压强不变时,1L
NO2高温分解,按2NO2 2NO+O2进行,达到平衡时气体体积变为1.2L,则NO2的分解率为( )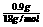 =0.05mol
=0.05mol
 =0.05mol
=0.05mol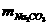 =5.3g
=5.3g =4.2g。
=4.2g。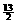 O2→4CO2+5H2O …… ①
O2→4CO2+5H2O …… ①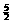 O2 …… ③
O2 …… ③ x+y=0.1mol
x+y=0.1mol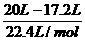

 若H2S完全燃烧: 2H2S + 3O2 点燃 2SO2+2H2O Δn(减小) n%
若H2S完全燃烧: 2H2S + 3O2 点燃 2SO2+2H2O Δn(减小) n%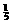 ×100%=20%
×100%=20%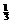 ×100%=33.3%
×100%=33.3%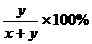 =28.6% y=0.400x
=28.6% y=0.400x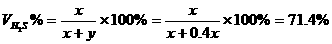
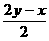 SO2+
SO2+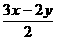 S+xH2O
Δn
S+xH2O
Δn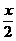
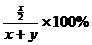 =28.6%
y=0.748x
=28.6%
y=0.748x
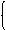 1.5x+y=0.15
1.5x+y=0.15 ≥0.15mol+0.15mol=0.3mol
≥0.15mol+0.15mol=0.3mol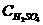 ≥
≥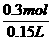 =2mol/L
=2mol/L
 1、认真审题:根据题意,写出正确的化学反应方程式或离子反应方程式或正确的关系式。这一点是有关化学方程式计算的前提。例如涉及H2S气体燃烧的有关计算首先要分析可能发生的化学方程式(O2不足,H2S过量:2H2S+O2 点燃 2S+2H2O;O2充足即过量,
1、认真审题:根据题意,写出正确的化学反应方程式或离子反应方程式或正确的关系式。这一点是有关化学方程式计算的前提。例如涉及H2S气体燃烧的有关计算首先要分析可能发生的化学方程式(O2不足,H2S过量:2H2S+O2 点燃 2S+2H2O;O2充足即过量,