网址:http://m.1010jiajiao.com/timu3_id_351256[举报]

根据以上信息,回答下列问题:
(1)E的电子式


(2)用碳棒作阳极,铁作阴极,电解滴有酚酞的A的饱和溶液.接通电源一段时间后,阴极附近溶液红色,其变红的原因是
(3)G→J的离子方程式为
(4)反应①中H能将L氧化,生成一种含氧酸盐M(其中某元素的化合价为+6)和其它两种物质,且H、L、D的物质的量之比为3:2:4,则H+L+D→M的化学方程式为
(5)鉴别等物质的量浓度的I、K稀溶液的实验方法为

(1)Z2的结构式是
| ||
| ||
(2)反应③的离子方程式是
(3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应.某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图乙所示(夹持固定装置的仪器已略去).
I、写出反应②的离子方程式
II、上述实验装置不够完善,改进方法是
Ⅲ、足量Z2 通入FeBr2溶液中发生反应的离子方程式是
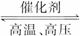
(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为_______________;A与甲反应在工业上一个重要用途是_______________。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式:_______________;丙与乙反应的化学方程式:_______________。

(3)若乙的水溶液呈弱碱性,并可用作农业化肥,D通常状况下为气体,则进行下列研究:现将0.40 mol C和0.20 mol D充入
①若t1=10 min,则0至t1时间内C物质的平均反应速率为_______________;该反应在t2时达到平衡,其化学反应方程式为_______________。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是_______________。
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D
查看习题详情和答案>>
(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为________________;A与甲反应在工业上一个重要用途是________________。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式:________________;丙与乙反应的化学方程式:________________。
(3)若乙的水溶液呈弱碱性,并可用作农业化肥,D通常状况下为气体,则进行下列研究:现将0.40 mol C和0.20 mol D充入

①若t1=10 min,则0至t1时间内C物质的平均反应速率为________________;该反应在t2时达到平衡,其化学反应方程式为________________。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是________________。
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D
查看习题详情和答案>>已知A、B、C、D为气体,其中A为黄绿色,D极易溶于水,形成的溶液可
使酚酞变红,它们之间的转化关系如下图①所示: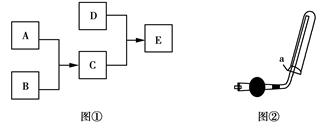
(1)将气体B点燃,把导管伸入盛满气体A的集气瓶,反应过程中的实验现象有 (填序号)
①放热 ②黄绿色褪去 ③瓶口有白雾 ④瓶口有白烟
⑤安静燃烧,发出黄色火焰 ⑥安静燃烧,发出苍白色火焰
(2)实验室制D的化学方程式为 。
(3)实验室可用如上图②所示装置收集D,下列叙述正确的是 (填序号)。
①D气体不能用排水法收集
②干燥管里盛有碱石灰
③图②中的a为棉花团,其作用是防止氨气逸出
(4)气体D催化氧化的化学方程式为 。
(5)物质E的化学式是 ;E在下列物质分类中所属的物质种类是 (填序号)。
①电解质;②化合物;③混合物;④纯净物;⑤非电解质;⑥盐