摘要:(一)选择题 1.某容积可变的密闭容器中放入一定量的A和B的混合气.在一定条件下发生反应:A2C(气).若维持温度和压强不变.当达到平衡时.容器的体积为V.此时C气体的体积占40%.则下列推断正确的是() A.原混合气体的体积为1.1V B.原混合气体为1.2V C.反应达到平衡时.气体A消耗了0.2V D.反应达到平衡时.气体B消耗了0.2V 2.根据+2e.Mn2++4H2OMnO-4+8H+5e.推测氧化1.5molMn2+需的物质的量为() A.1.5molB.3.75molC.3.25molD.3.125mol 3.1995年美国教授lagow报道.他制得了碳的第四种同素异形体--链式炔碳,-C≡C-C≡C-C≡C--.该物质的一个分子中含300500个碳原子.性质很活泼.据此判断链式炔碳的熔点.估计比石墨() A.高B.低C.相等D.无法判断 4.下列叙述不正确的是() A.0.012kgC-12含有的碳原子数就是阿伏加德罗常数 B.阿伏加德罗常数通常采用的近似值为6.02×1023 C.“摩尔 是物质粒子的数量单位.每摩物质含有阿伏加德罗常数个粒子 D.2mol氢分子与阿伏加德罗常数个氧分子完全反应.生成2mol水 5.已知某元素的阴离子Rn-?.原子核里的中子数为A-x+n.该元素原子的质量数为A.则mgRn-中的电子总数为(NA表示阿伏加德罗常数)() A.B. C. D. 6.某金属的最高价氧化物的相对分子质量为Mr.最高价氯化物的相对分子质量为Nr.若它的最高正价为X.则X与Nr.Mr的关系为 A.X一定等于B.X一定等于 C.X可能是D.以上全错 7.已知磷酸分子:中的3个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换.又次磷酸(H3PO2)也可跟D2O进行氢交换.但次磷酸二氢钠(NaH2PO2)却不能再跟D2O发生氢交换.由此可推断出H3PO2的分子结构是() 8.食盐晶体由钠离子和氯离子组成.这两种离子在空间的三个垂直方向都是等距离地交错排列.已知食盐的密度是2.2g/cm3.则食盐中相邻的钠离子核间的数值最接近于() A.3.0×10-8cmB.3.5×10-8cm C.4.0×10-8cmD.5.0×10-8cm 9.有可逆反应mApC.在一定温度条件下.B的体积分数B%与压强的关系如图所示.其中有关说法正确的是() A.m+n<pB.X点时反应的v正>v逆 C.n>pD.X点比Y点的反应速率慢 10.人体血液的pH保持在7.35-7.45.适量的CO2可维持这个pH变化范围.可用下面化学方程式表示:H2O+CO2H2CO3H++HCO-3.又知人体呼出的气体中CO2体积分数约5%.下列说法正确的是() A.太快而且太深的呼吸可以导致碱中毒 B.太快而且太深的呼吸可导致酸中毒 C.太浅的呼吸可以导致酸中毒 D.太浅的呼吸可以导致碱中毒 11.将一定量的Ag2SO4固体置于容积不变的密闭容器中.某温度下.发生下列反应:Ag2SO4Ag2O+SO3(g),2SO3(g)2SO2(g)+O2(g)经10min反应到达平衡.此时[SO3]=0.4mol/L,[SO2]=0.1mol/L.那么下列叙述错误的是() A.SO3的分解率为20% B.到达平衡时.=0.05mol/ C.容器内气体的密度为40g/L D.上述A.B.C均不正确 12.现有3个体积相等的密闭容器.都进行下列反应:CO2+H2H2O(g)+CO.反应所处的温度相同.但起始浓度不同.其中甲:n(CO2)=n(H2)=amol;乙:n(CO2)=amol,n(H2)=2amol,丙:n(CO2)=n(H2)=n[H2O(g)]=amol.达到平衡时CO的物质的量由大到小的顺序是() A.甲>乙>丙B.甲>丙>乙 C.乙>丙>甲D.乙>甲>丙 13.同温下两种稀醋酸:甲溶液的物质的量浓度为C.电离度为α;乙溶液[CH3COO-]=C.电离度为α′.下列的有关叙述中.正确的是() A.α<α′ B.乙溶液物质的量浓度为C/α′ C.甲溶液的pH等于乙溶液的pH D.甲溶液的[H+]与乙溶液的[H+]之比为1/α′ 14.t℃时.某一元弱酸溶液中.溶质的分子与溶质电离出来的离子的物质的量之比为m∶n.则该一元酸在t℃时的电离度是() A.B. C.D. 15.在25℃时.在浓度为1mol/L的(NH4)2SO4.(NH4)2CO3.(NH4)2Fe(SO4)2溶液中.测得其[NH+4]分别为a.b.c.下列判断正确的是() A.a=b=cB.a>b>cC.a>c>bD.c>a>b 16.四种盐都是一元酸和一元碱反应生成的.实验测得盐AX和BY的水溶液pH都等于7.AY的水溶液pH>7.BX水溶液pH<7.下列结论正确的是() A.盐AX和BY没有发生水解.盐AY和BX发生了水解 B.酸性HX>HY.碱性AOH>BOH C.等物质的量的AY和BX的混合物溶于水.溶液呈中性 D.等物质的量浓度的HX溶液和HY溶液的pH值前者大于后者 17.含的酸性工业废水会造成铬污染.排放前先将还原成Cr3+.并转变为Cr(OH)3除去.工业上采用的方法是向废水中加入NaCl.以铁为电极进行电解.同时鼓入空气.结果溶液的pH值不断升高.溶液由酸性转为碱性.在以上处理过程中.溶液pH值升高的原因是() A.电解时废水体积减小 B.鼓入空气使溶液中OH-浓度增大 C.电解时H+在阴极被还原 D.被还原为Cr3+时消耗了H+ 18.下列离子方程式不正确的是() A.1molNaOH和1L2mol/L的H3PO4溶液反应:H3PO4+OH-+H2O B.碳酸钠溶液和稀醋酸反应:+2H+H2O+CO2↑ C.少量CO2气体通入过量的纯碱溶液中:CO2+H2O+2HCO-3 D.三氯化铁溶液中加入过量氨水:Fe3++2NH3·H2OFe(OH)3↓+3NH+4 19.下列离子中既能在溶液中大量共存.在将溶液的pH调到0.3时又会出现浑浊的离子组是() A.Al3+.K+.I-.SiOB.Fe2+.Fe3+.NH.NO C.Na+.HS-.HCO-3.NO-3D.Ag(NH3)+2.OH-.K+.Cl- 20.下列各组离子一定能在指定环境中大量共存的是() A.在[HCO]=0.1mol/L的溶液中:Al3+.Cl-.NO B.在由水电离出的[H+]=10-12mol/L的溶液中:Fe2+.ClO-.Na+.SO C.在使甲基橙变红的溶液中:NO.SO.Na+.Fe3+ D.在使pH试纸变深蓝色的溶液中.SO.S2-.Na+.K+ 21.已知一定温度下的某弱电解质稀溶液.当加水稀释使物质的量浓度变为原来的时.其电离度将增大到原溶液电离度的倍.现有pH=2的某一元弱酸溶液10mL.加水至1L后.溶液的pH是() A.等于4B.在3-4之间C.等于3D.在2-3之间 22.对重水(D2O)(常温下D2O的离子积是1.6×10-15).可以用和pH一样的定义来规定重氢离子的负对数pD(即-lg[D+]).下列关于pD的叙述中正确的是() A.中性重水的pD为7 B.在1L重水中溶解0.01molDCl.设溶液体积为1L.其pD为4 C.在重水中溶解0.01molNaOD.其pD为12 D.在100mL0.25mol/L的DCl重水溶液中加入50mL0.2mol/L的NaOD重水溶液时.pD为1 23.将0.2mol/L的Ba(OH)2溶液跟0.15mol/L的KHSO4溶液等体积混合.溶液中离子浓度大小顺序正确的是() A.[OH-]>[K+]>[Ba2+]>[SO] B.[OH-]>[K+]>[Ba2+]=[SO] C.[K+]>[OH-]>[Ba2+]>[SO] D.[K+]>[OH-]>[SO]>[Ba2+] 24.下列各组离子中.在碱性溶液中共存.且加入盐酸过程中.会产生气体和沉淀的是() A.Na+.NO.AlO-2.SOB.Na+.NO.SiO.K+ C.K+.Cl-.AlO.COD.K+.Cl-.HCO.Ca2+ 25.将含0.75molNaOH和0.5molH3PO4两溶液混合.若反应后溶液仍是酸性.下列离子浓度大小排列正确的是() A.Na+>HPO>H2PO>H+B.Na+>H2PO>HPO>H+ C.Na+>HPO>H+>H2POD.H2PO>Na+>HPO>H+ 26.将1Lmol/L的纯碱溶液慢慢滴入1L1.25mol/L的盐酸中.或将1L1.25mol/L的盐酸慢慢滴入1L1mol/L的纯碱溶液中.这两种操作产生的气体体积比是() A.1∶1B.5∶2C.2∶5D.2∶1 27.下列各组物质中.在常温下既能与NaOH反应.又能与H2SO4溶液反应.但都没有气体产生的一组是() A.Al与Al2O3 B.NaHCO3与 C.Al(OH)3与Ca(H2PO4)2 D.(NH4)2S与Fe(NO3)3 28.用足量CO还原14g铁的氧化物.将生成的CO2通入足量澄清石灰水.得沉淀25g.则该物质不可能是() A.FeO和Fe2O3的混合物B.Fe2O3和Fe3O4的混合物 C.FeO和Fe3O4混合物D.纯净的Fe3O4 29.过氧化氢的沸点比水高.但受热容易分解.某试剂厂先制得7%-8%的过氧化氢溶液.再浓缩成30%溶液时.可采用的适宜方法是() A.常压蒸馏B.减压蒸馏 C.加生石灰后常压蒸馏D.加压蒸馏 30.Cl2在70℃的NaOH水溶液中.能同时发生两个自身氧化还原反应.反应完全后测得溶液中NaClO和NaClO3的物质的量比为4∶1.则溶液中NaCl和NaClO的物质的量之比为() A.9∶4B.5∶1C.11∶2D.1∶1 31.有一瓶澄清的溶液.其中可能含有NH.K+.Na+.Mg2+.Ba2+.Al3+.Fe3+.SO.CO.NO.Cl-和I-.取该溶液进行以下实验:①用pH试纸测定溶液呈强酸性,②取部分溶液.加入少量CCl4及数滴新制的氯水.经振荡后CCl4呈紫红色.③取部分溶液.逐滴加入稀NaOH溶液.使溶液从酸性逐渐变为碱性.在滴加过程中及滴加完毕后.溶液中均无沉淀生成,④取部分上述碱性溶液.加Na2CO3溶液有白色沉淀生成,⑤将③得到的碱性溶液加热.有气体放出.该气体能使湿润的红色石蕊试纸变蓝.根据上述实验事实可知.在该溶液中肯定存在的离子组是() A.I-.K+.Na+ B.CO.NH.SO C.I-.Ba2+.NH+4 D.Ma2+.Fe3+.Ba2-? 32.1995年诺贝尔化学奖授予致力研究臭氧层被破坏问题的三位环境化学家.大气中的臭氧层可滤去大量的紫外线.保护地球的生物.氟里昂(如CCl2F2)可在光的作用下分解.产生Cl原子.Cl原子会对臭氧层产生长久的破坏作用(臭氧的化学式为O3).有关反应为: O3O2+OCl+O3ClO+O2ClO+OCl+O2总反应:2O33O2 (1)在上述臭氧变成氧气的反应过程中.Cl是() A.反应物 B.生成物 C.中间产物 D.催化剂 (2)O3和O2是() A.同分异构体 B.同系物 C.氧的同素异形成 D.氧的同位素 33.工农业及城市生活污水中含磷.家用洗涤剂是污水中磷的一个重要来源.处理污水时要不要除磷?() A.磷是生物的营养元素.故不必除去 B.含磷污水是很好的磷肥.故不必除去 C.含磷的污水排到自然水中引起藻类增殖.使水变质.故必须除去 D.磷对人无毒.除去与否无关紧要 34.下图两个装置中.溶液体积均为200mL.开始时电解质溶液的浓度均为0.10mol/L.工作一段时间后.测得导线上通过0.02mol电子.若不考虑盐的水解和溶液体积的变化.则下列叙述中正确的是() A.产生气体的体积:①>② B.电级上析出固体的质量:①>② C.溶液的pH值变化:①减小,②增大 D.电极反应式:①中阳极4OH--4e=2H2O+O2?②中负极2H++2e=H2 35.某金属最高价氧化物相对分子质量为M.最高价氯化物的相对分子质量为N.设该金属最高正价为X.则X与M.N的关系是 A.一定等于B.一定等于 C.X可能等于D.以上都不对 36.N2H4称为肼或联氨.N2H4和NH3的关系有如H2O2和H2O的关系.肼能发生下列反应,N2H4+H3O+N2H+H2O.N2H4+H2ON2H+OH-.N2H+H2ON2H+OH-.N2H+H2O N2H4+H3O+.今有下列结论:①肼水解显酸性,②肼在水中电离出H+离子,③肼是二元弱碱,④肼是二元弱酸,⑤肼分了中孤对电子数比H2O2分子中的孤对电子数少,⑥肼分子的热稳定性比氨强.其中正确的是() A.①②④B.②④⑤C.①③⑤⑥D.只有③⑤ 37.反应2X2Z(气)+热量.在不同温度(T1和T2)及压强(P1和P2)下.产物Z的物质的量的关系如图所示.下列判正确的是() A.T1<T2.P1<P2B.T1<T2.P1>P2 C.T1>T2.P1>P2D.T1>T2.P1<P2 38.在容积相同的两密闭容器A和B中.保持温度为150℃.同时向A容器中加入amolHI.向B容器中加入bmolHI.当反应2HIH2(g)+I2(g)达到平衡后.下列说法正确的是() A.从反应开始达到平衡.所需时间tA>tB B.平衡时[I2]A=[I2]B C.平衡时I2蒸气在混合气体中的体积分数:A容器大于B容器 D.HI的平衡分解率aA=aB 39.用0.01mol/LH2SO4.滴定0.01mol/LNaOH溶液.中和后加水至100mL,若滴定时终点判断有误差:①多加了1滴H2SO4,②少加了1滴H2SO4.则①和②中[H+]离子浓度之比的值是() A.10B.50C.5×103D.104 40.设NA为阿伏加德罗常数.下列说法正确的是() A.标准状况下22.4LSO3含有NA个SO3分子 B.60g二氧化硅中含有4NA个Si-O键 C.1.9gH3O+中含有1.1NA个质子 D.1molCl2通入热的NaOH溶液中(主要产物是NaCl.NaClO3).充分反应后.转移电子数为NA个
网址:http://m.1010jiajiao.com/timu3_id_350953[举报]
(17分)某反应A(g)+B(g) C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示:
C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示:
υ正=k1·c(A)·c(B),υ逆=k2·c(C),其中k1、k2在一定温度下为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度。
(1)上述反应达到平衡时,请用题干中的符号分别表示三种物质的浓度关系为 ,
平衡常数K=_ __。
(2)在300 K时,开始反应的A、B浓度均为0.1 mol/L,达到平衡时B的转化率为50%,则k1、k2之间的关系是__________________。
(3)升高温度,k1的变化是 ,k2的变化是_________(填“增大”、“减小”或“不变”);此时若k1/k2增大,则说明正反应是___________(填“吸”或“放”)热反应。
(4) CO2可与H2合成绿色燃料甲醇。300oC时,在两个容积均为2L的密闭容器中,当c(CO2)=1.00 mol·L-1、c(H2)=1.60 mol·L-1时,分别选择催化剂Ⅰ、催化剂Ⅱ开始反应,t0时达到平衡状态M1、M2。若υ逆(M1)<υ正(M2)。且达M1时,CO2的转化率为20%,请画出两个状态的浓度商(Qc)-时间(t)的关系图像,并标明相关数据。
=
(5)实验室可利用甲醇、空气、铜(或氧化铜)制备甲醛。关于甲醇和甲醛的沸点和水溶性见下表:
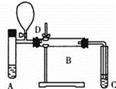
下图是某同学设计的实验装置,已知A处放入甲醇,C处收集到甲醛,若D处的气球在反应临近结束时使用,则B处应放入______(填化学式),请回答A、B、C三处采取控温的方式分别为A_____、B 、C ,(从下列选项中选择)
a.热水浴加热 b.冰水浴冷却 c.酒精灯加热 d.酒精喷灯灼烧 e.常温即可
实验临近结束时,挤压D处气球使空气进入装置,该操作的目的是____________________。
 C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示:
C(g)在任一时刻的正、逆反应速率可用υ正、υ逆表示:
υ正=k1·c(A)·c(B),υ逆=k2·c(C),其中k1、k2在一定温度下为常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度。
(1)上述反应达到平衡时,请用题干中的符号分别表示三种物质的浓度关系为 ,
平衡常数K=_ __。
(2)在300 K时,开始反应的A、B浓度均为0.1 mol/L,达到平衡时B的转化率为50%,则k1、k2之间的关系是__________________。
(3)升高温度,k1的变化是 ,k2的变化是_________(填“增大”、“减小”或“不变”);此时若k1/k2增大,则说明正反应是___________(填“吸”或“放”)热反应。
(4) CO2可与H2合成绿色燃料甲醇。300oC时,在两个容积均为2L的密闭容器中,当c(CO2)=1.00 mol·L-1、c(H2)=1.60 mol·L-1时,分别选择催化剂Ⅰ、催化剂Ⅱ开始反应,t0时达到平衡状态M1、M2。若υ逆(M1)<υ正(M2)。且达M1时,CO2的转化率为20%,请画出两个状态的浓度商(Qc)-时间(t)的关系图像,并标明相关数据。
=

(5)实验室可利用甲醇、空气、铜(或氧化铜)制备甲醛。关于甲醇和甲醛的沸点和水溶性见下表:
| | 沸点 | 水溶性 |
| 甲醇 | 65℃ | 与水相溶 |
| 甲醛 | -21℃ | 与水相溶 |
a.热水浴加热 b.冰水浴冷却 c.酒精灯加热 d.酒精喷灯灼烧 e.常温即可
实验临近结束时,挤压D处气球使空气进入装置,该操作的目的是____________________。