28、汽油中支链烃和环烃越多,汽油质量越高,通常用辛烷(C8H18)值来表示汽油质量。辛烷值越高,汽油的质量就越高。无铅汽油通常是加入甲基叔丁基醚作为高辛烷值组成。甲基叔丁基醚难溶于水。用以下两种方案制甲基叔丁基醚。
|
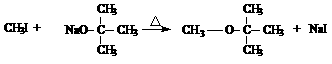
|
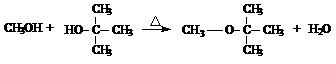
(1)叔丁醇有四种醇类同分异构体,写出其中一种的结构简式___________________,它还有多种醚类同分异构体,其中一种可由乙醇在浓硫酸作用下分子间脱水生成,其结构简式为_________________________。
(2)已知醇在铜的催化下可发生氧化反应,如

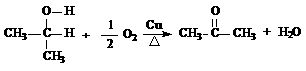
试推测叔丁醇是否能发生类似反应_______(填“能”、“不能”)。
(3)已知CH3CH2OH有三种不同化学环境的氢原子,则叔丁醇有________不同化学环境的氢原子。
(4)方案乙不如方案甲,因为方案乙会发生两种类型的副反应,生成________________、______________________、______________________(写结构简式)等副产品。
(5)甲方案中要分离两种生成物,得到甲基叔丁基醚粗产品的方法是________。
a.水洗分液法 b.分馏法 c.过滤法
26(A)、工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
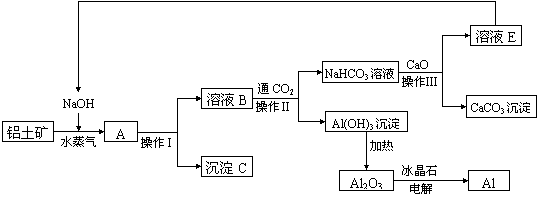

请回答下列问题:
(1)沉淀C的化学式为__________,该物质除了用于金属冶炼以外,还可用作________。
(2)电解熔融的氧化铝时,冰晶石的作用是______________________________________。
(3)操作I、操作II、操作III都是_________(填操作名称),实验室进行该操作,需要的玻璃仪器有_________________________________;实验室要洗涤Al(OH)3沉淀,应该在________________装置中进行,判断沉淀已经洗净的方法是______________________ _________________________________________。
(4)生产过程中,除NaOH、H2O可以循环使用以外,还可以循环使用的物质有__________ __________________(填化学式) 。请在流程图上用带箭头的线段表示循环使用的情况。
(5)若某工厂每月生产中参加反应的NaOH为20吨,未参加反应损失的NaOH为0.1吨,该工厂每月要购买的NaOH为_______吨。
26(B)、物质分析的方法通常有重量法、容量法(滴定法)、气体体积法。粉笔由白垩(碳酸钙)制成。为增加硬度,还掺入了适量的硫酸钙。某学习小组为测定粉笔中碳酸钙的质量分数,设计了以下实验。
 方案一、重量法
方案一、重量法
将粉笔研细,加强热,使其发生反应: CaCO3 CaO + CO2↑。
①加热后,须待冷却后才能称量,应在___________中(填仪器名称)冷却。
②若粉笔反应前质量为m1 g,加热至恒重后质量为m2 g,则CaCO3的质量分数为__________________。
③该小组的同学经过思考,认为要使实验可靠,还需查阅几个数据,这些数据包括(请写出其中一个) ________________________________________________。
方案二、滴定法
称取1.200g 研细的粉笔,加入过量的30.00mL 浓度为1.000 mol·L-1的盐酸,再加2滴酚酞,用1.000 mol·L-1的NaOH溶液滴定。
④该实验要用到下列仪器中的___________________(填序号)。
a.电子天平 b.托盘天平 c.滴定管 d.锥形瓶
⑤若到滴定终点时消耗NaOH溶液10.00mL,则粉笔中CaCO3的质量分数为___________%。
⑥某同学做了3次平行实验,耗用的NaOH溶液体积基本相同,可是测得的CaCO3的质量分数都比其它同学高,可能的原因是________________(写出其中一点)。
⑦你认为以上两种方案中较好的是方案______________。
27、硫酸铜晶体(蓝色)在110℃开始失去部分结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体结晶水含量的测定方法。请将有关内容填入下表中空白部分(M(CuSO4)=159.5g/mol,M(H2O)=18.0g/mol)
|
(1)实验记录 |
坩埚 质量 |
坩埚和晶体的总质量W1 (g) |
加热后坩埚和剩余固体的质量W2 (g) |
结晶水含量的测定值(保留2位小数) |
实验误差(保留两位小数) |
误差(填“偏高”、“偏低”) |
|
11.685g |
13.691g |
12.948g |
_________ |
_________ |
_________ |
|
|
(2)误差及分析 |
造成本次误差可能的原因________________(填序号) a. 实验前坩埚不干燥 b. 加热时有晶体溅出 c. 加热时坩埚内物质变黑 d. 加热后放在空气中冷却 你认为还有可能存在的其他原因____________________________________________ _________(写出其中一点) |
|||||
|
(3)实验小结 |
①通过实验知道,要完成此实验,至少要称量____________次 a.2 b.3 c.4 d.5 ②如果硫酸铜晶体样品不纯,测定结果________________ a.没有偏差 b.一定偏小 c.一定偏大 d.无法确定 |
25、在一个容积固定的密闭容器中,发生如下反应: aA(g) + bB(g)  pC(g)
+Q(Q>0)。
pC(g)
+Q(Q>0)。
反应情况如下表:
|
时间 |
c(A)(mol/L) |
c(B)(mol/L) |
c(C)(mol/L) |
|
起始 |
1 |
3 |
0 |
|
第2min |
0.8 |
2.6 |
0.4 |
|
第4min |
0.4 |
1.8 |
1.2 |
|
第6min |
0.4 |
1.8 |
1.2 |
|
第8min |
0.1 |
2.0 |
1.8 |
|
第9min |
0.05 |
1.9 |
0.3 |
根据表中提供的信息,回答:
(1)a=___________,b=_________,p=___________(取最小整数)。
(2)写出该反应的平衡常数表达式K=_____________________。升高温度,K值将__________(填“增大”、“减小”、“不变”)
(3)由表中数值可知在反应第2min到第4min内A的平均速率为_________mol/L·min。
(4)由表中数据可知反应在第4min到第6min处于平衡状态,若在第2min、第6min、第8min分别改变了某一反应条件,改变的条件可能是:第2min_____________或_________,第6min____________________,第8min____________________。
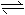 C.碳酸钠溶液显碱性:CO32-
+2H2O
H2CO3 +2OH-
C.碳酸钠溶液显碱性:CO32-
+2H2O
H2CO3 +2OH-  D.将二氧化锰固体加入浓盐酸中加热
4H+ +2Cl- +MnO2 Mn2+ +Cl2↑+2H2O
D.将二氧化锰固体加入浓盐酸中加热
4H+ +2Cl- +MnO2 Mn2+ +Cl2↑+2H2O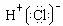 A.一个D2O分子所含的中子数为8 B.热稳定性:H2S>HF
A.一个D2O分子所含的中子数为8 B.热稳定性:H2S>HF 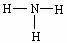 C.HCl的电子式为
D.NH3的结构式为
C.HCl的电子式为
D.NH3的结构式为 CO + 3H2
,该厂每天能生产多少立方米水煤气(标准状况)?
CO + 3H2
,该厂每天能生产多少立方米水煤气(标准状况)?