23(A)、
表中的黑线是表示元素周期表中金属元素与非金属元素的分界线。
(1)以下说法正确的是______________(填序号)
a.可在分界线附近找到制半导体材料的元素 b.可在表的右上角寻找制造农药的元素 c.除氢元素外,非金属元素原子的最外层电子数大于其电子层数
(2)已知从上到下,稀有气体元素的原子序数分别是2、10、18、36、54、86,试推测若发现117号元素,它应位于元素周期表的第_______ 周期第_______族,根据金属元素与非金属元素的分界线走势,推测该元素是__________(填“金属”、“非金属”)元素。
(3)有人认为金属元素的最高价氧化物可分为碱性氧化物、两性氧化物两大类,你认为这种看法______ (填“合理”、“不合理”) ,举一例说明__________________________ ____________________________________(若答“合理”,此空可不填)。
23(B)、下表是一些共价键键能数据(单位:kJ/mol)
|
共价键 |
键能 |
共价键 |
键能 |
共价键 |
键能 |
|
H-H |
436 |
Cl-Cl |
243 |
H-O |
464 |
|
H-F |
565 |
H-Cl |
432 |
H-S |
339 |
|
C-F |
427 |
C-Cl |
330 |
C-I |
218 |
试回答下列问题
(1)以下结论肯定正确的是_________(填序号)
a.原子半径越小的原子形成的共价键越牢固
b.非金属性越强的原子形成的共价键越牢固
c.同主族元素分别与氢元素形成共价键时,原子半径越小,键越牢固
(2)请预测C-Br键的键能范围:___________< C-Br < ____________
(3)已知反应物和生成物均为气态时,化学反应的反应热等于生成物的键能总和减去反应物的键能总和。则热化学方程式 H2(g) + Cl2(g) → 2HCl(g) + a kJ中,a=______(填具体数值)kJ。
(4)卤代烃RX,在相同条件下发生碱性水解反应时(设R相同),RF、RCl、RBr、RI的反应速度由大到小的顺序为_________________________________。
24、(1)配平下列化学方程式
____ KClO3 + ____HCl → ____ClO2 + ____Cl2 +____KCl + ____H2O
反应中的氧化剂是____________ ,当有0.4molHCl参加反应时,电子转移数为_________________个。
(2)已知氧化性(酸性条件)BrO3- > IO3- >Br2 >I2 。以下方程式错误的是_______
a. IO3- + Br- → I- + BrO3-
b.6I- + BrO3- + 6H + → 3I2 + Br- + 3H2O
c.5I- + 6BrO3- + 6H + → 3 Br2 + 5 IO3- + 3H2O
d.5I- + 2BrO3- + 6H + → Br2 + IO3- + 2I2 + 3H2O
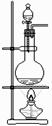
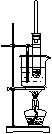 以下各实验装置中,错误的是
以下各实验装置中,错误的是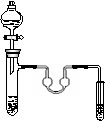
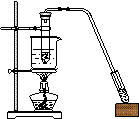
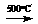 C;
D + E
C;
D + E 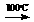 F
F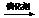 CH3CH=
CHCH3 + CH2=CH2。
CH3CH=
CHCH3 + CH2=CH2。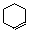 C.CH3CH2C≡CH + CH3CH2C≡CH
C.CH3CH2C≡CH + CH3CH2C≡CH