|
(3)②4NH3+5O2 = 4NO+6H2O (4)⑤C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
|
(5)2NH4++2e- = 2NH3↑+H2↑
24. (10分) (1) H2O2 CO2 Fe3O4 (各1分)
(2) FeC2O4 CO↑+CO2↑+FeO (3分)
CO↑+CO2↑+FeO (3分)
(3) 4 HCl + MnO2

 MnCl2 + Cl2 ↑ + 2H2O (2分)
MnCl2 + Cl2 ↑ + 2H2O (2分)
(4) 2Fe3+ + Fe = 3 Fe2+ (2分)
26. (8分)铁粉和铜粉的均匀混合物,平均分成三等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
|
剩余金属/g |
30.4 |
22 |
12.8 |
|
NO体积/mL |
2240 |
4480 |
6720 |
由上述数据推测:
(1)求硝酸的物质的量浓度。
(2)③中比②中多溶解金属的成分是什么?其相应的质量为多少克?
(3)向反应后的①中加入足量的该稀硝酸时,又生成气体的体积在标准状况下为多少L?
高三化学综合练习(五)答案:
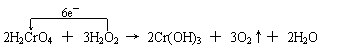
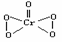
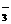 +3e-=NO↑+2H2O
+3e-=NO↑+2H2O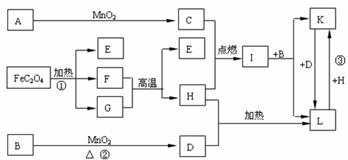 (10分)下列A-L 11种物质是中学化学常见物质,其中C、D、E、F为气体,C、D、H为单质。1 mol FeC2O4在反应①中转移1 mol电子。它们有如下图所示的转化关系(部分反应中的生成物已略去),试回答:
(10分)下列A-L 11种物质是中学化学常见物质,其中C、D、E、F为气体,C、D、H为单质。1 mol FeC2O4在反应①中转移1 mol电子。它们有如下图所示的转化关系(部分反应中的生成物已略去),试回答: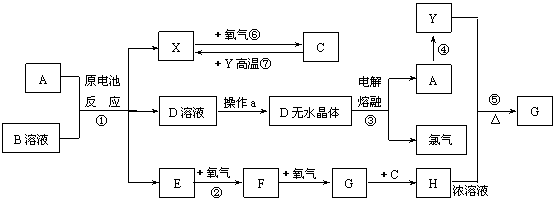 (注意:其中有些反应的条件及部分生成物被略去)
(注意:其中有些反应的条件及部分生成物被略去) (8分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应
(8分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应