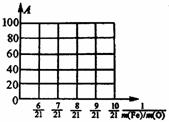
5.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能 / kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
下列叙述正确的是
A.由于Si-C的键能大于Si-Si的键能,所以SiC的熔点高于晶体硅的熔点
B.由于Si-O的键能大于Si-Cl的键能,所以SiO2的熔点高于晶体SiCl4的熔点
C.SiCl4(g)+2H2(g) Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1+4×431kJ·mol-1 )
Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1+4×431kJ·mol-1 )
D.SiCl4(g)+2H2(g) Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1-4×431kJ·mol-1 )
Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1-4×431kJ·mol-1 )
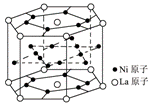 氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
 HClO+OH-不是酸碱反应
C.2Na+2H2O=2NaOH+H2↑是酸碱反应
D.碱性强弱顺序:C2H5O->OH->C6H5O-
HClO+OH-不是酸碱反应
C.2Na+2H2O=2NaOH+H2↑是酸碱反应
D.碱性强弱顺序:C2H5O->OH->C6H5O- 2FeO+CO2
2FeO+CO2