1.“-OH”化学上称为羟基,上个世经60年代美国化学家鲍林提出一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数。鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)有如下关系:
|
m-n |
0 |
1 |
2 |
3 |
|
酸的强弱 |
弱 酸 |
中 强 |
强 |
很 强 |
|
实 例 |
HClO |
H3PO4 |
HNO3 |
HClO4 |
(1) 按此规则判断H3AsO4、H2CrO4、HMnO4酸性由强到弱的顺序为_________________________________________。
(2) H3PO3和H3AsO3的分子组成相似,但酸性强弱相差很大,已知H3PO3为中强酸,H3AsO3为弱酸。试推断有关酸的结构式H3PO3_____________ H3AsO3_____________。
3.某化学研究性学习小组在研究KClO3制取氧气实验时查得如下资料:
资料一:KClO3单独加热到3630C时熔融,在3800C时发生两个反应:
①4KClO3=3KClO4+KCl ②2KClO3=2KCl+3O2↑
加热至4000C以上时KClO4又发生分解,放出大量的O2。
资料二:若用MnO2作催化剂,则KClO3在2000C时就能迅速分解,但制得的氧气中有氯气的气味,生成的氯化钾又略带紫红色,反应过程如下:
③2KClO3+2MnO2=2KMnO4+Cl2↑+O2↑ ④2KMnO4=K2MnO4+MnO2+O2↑
⑤Cl2+K2MnO4=2KCl+MnO2+O2↑
资料三:部分物质的物理性质
|
物质 颜色的状态 |
密度/g·cm3 |
00C时溶解度/g |
1000C时溶解度/g |
|
KCl 无色晶体 |
1.98 |
27.6 |
56.7 |
|
KClO3 无色晶体 |
2.32 |
3.3 |
57 |
|
KClO4 无色晶体 |
2.52 |
0.75 |
21.8 |
(1)在KClO3与KClO4中,热稳定性较好的是___________。
(2)单独加热KClO3制取氧气时,试管口应稍向 (填“上”或“下”)倾斜,证明生成物中有KCl的方法是:_________________。假设资料一中只发生反应①,则证明有KClO4生成的实验方法是______________________________。
(3)若用MnO2作催化剂制取氧气时,反应③中氧化产物是______(填化学式),按该反应过程,若制取1.5molO2,总共有______mol电子发生转移。
(4)若用MnO2作催化剂加热KClO3时,两者质量比以MnO2占1/3为最好。若用占1/10的MnO2和KClO3共热时,开始放出氧气较慢,继续加热至一定温度时,放出氧气的速率会很快,其主要原因可能是___________________________。
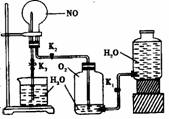 (1)该实验的目的是
。
(1)该实验的目的是
。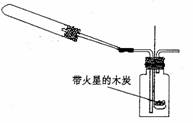 (2)乙组同学通过查阅资料得知,一些不活泼金属的硝酸盐受热时也能产生NO2气体,
(2)乙组同学通过查阅资料得知,一些不活泼金属的硝酸盐受热时也能产生NO2气体,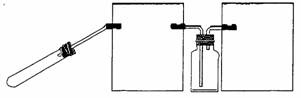 (3)丙组同学拟设计一个用较为纯净的NO2气体(无O2产生)来探究“NO2能否支持燃烧”的实验。
(3)丙组同学拟设计一个用较为纯净的NO2气体(无O2产生)来探究“NO2能否支持燃烧”的实验。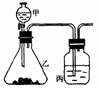 6.化学虽然是一门知识比较繁杂的学科,但有极强的规律性,要学好化学
6.化学虽然是一门知识比较繁杂的学科,但有极强的规律性,要学好化学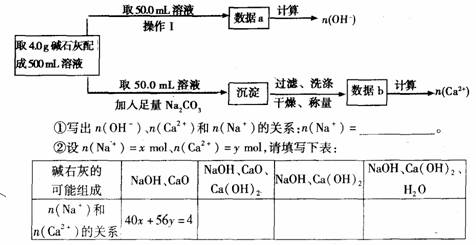
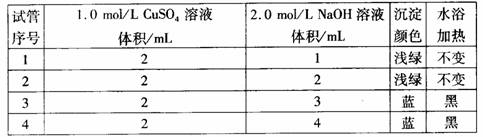 某实验小组的同学探究氢氧化铜的制法。实验记录为
某实验小组的同学探究氢氧化铜的制法。实验记录为 实验:
实验: