21. (7分)在1000C时,将0.100mol的N2O4气体充入1L的真空密闭恒容容器中,已知容器中的反应为N2O4(g) 2NO2(g) ∆H>0 。每间隔20秒对该容器内的物质进行分析,得到数据如表,请回答:
(7分)在1000C时,将0.100mol的N2O4气体充入1L的真空密闭恒容容器中,已知容器中的反应为N2O4(g) 2NO2(g) ∆H>0 。每间隔20秒对该容器内的物质进行分析,得到数据如表,请回答:
|
时间(S) 浓度 (mol/L) |
0 |
20 |
40 |
60 |
80 |
|
C(N2O4) |
0.100 |
a |
0.050 |
c |
d |
|
C(NO2) |
0.000 |
0.060 |
b |
0.120 |
0.120 |
(1)20S时N2O4浓度a= ;在0~20S内N2O4的平均反应速率为
表中bcd之间的大小关系为 。
(2)该反应达到平衡时N2O4的转化率为 ;若对该平衡混合气进行加热,则其平均相对分子质量将 (填“增大、减小、不变”)。
(3)若在相同条件下,最初向该容器中充入的是NO2气体,要达到上述相同的平衡状态,NO2的起始浓度应为 。
(4)若在相同条件下,往原平衡体系中再通入0.20molNO2气体,重新达到平衡时容器内的NO2物质的量为 。
A.大于0.12mol,小于0.24mol B.等于0.24mol
C.大于0.24mol,小于0.32mol D.等于0.32mol
18.(6分)(1)已知在常温下测得浓度均为0.1mol/L的下列溶液的PH:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
PH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
根据上述信息判断,浓度均为0.5mol/L的下列6种溶液,PH最小的是 (填序号);其PH为 (填数值);PH最大的为 (填序号)
① C6H5OH②CH3COOH③HCN④HClO⑤H2SO4⑥HClO4
(2)下列转化都属于复分解反应:
①工业上将石灰乳与纯碱混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体
根据上述反应,总结出复分解反应发生的一个规律:
;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是 ,请写出反应的离子方程式 。
16.
 (10分)煤化工生产中常需研究在不同温度下的化学平衡常数、投料比及热值等问题。已知:CO(g)+H2O(g) H2(g)+
CO2(g)平衡常数随温度的变化如下表:
(10分)煤化工生产中常需研究在不同温度下的化学平衡常数、投料比及热值等问题。已知:CO(g)+H2O(g) H2(g)+
CO2(g)平衡常数随温度的变化如下表:
|
温度/0C |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
试回答下列问题:
(1)上述正反应是 反应(填:“放热”或“吸热”)。
(2)在8000C发生上述反应,以表中的物质的量投入恒容反应容器,,其中向正反应移动的有 (填序号)。
|
序号 |
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
3 |
3 |
0 |
0 |
|
D |
0.5 |
2 |
1 |
1 |
|
E |
3 |
1 |
2 |
1 |

 (3)已知在一定温度下,C(s)
+ CO2(g) 2CO(g)平衡常数为K,C(s) +H2O(g) CO(g)+H2(g)平衡常数为K1;CO(g)+H2O(g) H2(g)+CO2(g)平衡常数为K2。则K、K1、K2之间的关系为是:
。
(3)已知在一定温度下,C(s)
+ CO2(g) 2CO(g)平衡常数为K,C(s) +H2O(g) CO(g)+H2(g)平衡常数为K1;CO(g)+H2O(g) H2(g)+CO2(g)平衡常数为K2。则K、K1、K2之间的关系为是:
。
(4)若在5000C时进行,设起始时CO和H2O初始的浓度均为0.020moL/L,求该条件下CO的平衡转化率(写出计算过程,)。
(5)在VL容器中通入10 mol CO和10 mol水蒸气,在T0C达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2842KJ(已知CO的燃烧热为283KJ/mol,H2的燃烧热为286KJ/mol),则T0C的平衡常数K为 。
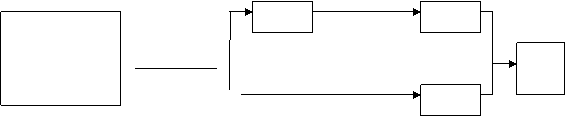
 (9分)已知:CH2=CH-CH=CH2
+ CH2=CH2 ∆ 物质A在体内脱氢
(9分)已知:CH2=CH-CH=CH2
+ CH2=CH2 ∆ 物质A在体内脱氢 HCHO
HCHO
 (2)写出化合物B的结构简式:
(2)写出化合物B的结构简式:
 冷却
冷却 (1)已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。
(1)已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。