[vii].(15分)工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)
+ 4C(s)  4CO(g) + BaS(s)
⊿H1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
⊿H1 = +571.2 kJ·mol-1 ①
BaSO4(s)
+ 2C(s)  2CO2(g) + BaS(s) ⊿H2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) ⊿H2= +226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。
Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, = 。
= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶实际生产中必须加入过量的炭,同时还要通入空气,其目的是
。
[viii].(20分)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 =4LiCl+S +SO2。请回答下列问题:
⑴电池的负极材料为 ,发生的电极反应为 ;
⑵电池正极发生的电极反应为 ;
⑶SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
⑷组装该电池必须在无水、无氧的条件下进行,原因是
。
[ix].(17分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
⑴下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
⑵用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ⊿H=+64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) ⊿H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ⊿H=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:
。
⑶控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率(×10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
。
⑷在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
[i].下列热化学方程式正确的是(⊿H的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);⊿H= -1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);⊿H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g);⊿H= -269.8kJ/mol(反应热)
D.2NO2==O2+2NO;⊿H=+116.2kJ/mol(反应热)
[ii].下列有关叙述正确的是
A.某物质的溶液pH <7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(OH-)是pH=6.5的牛奶中c(OH-)的100倍
C.AgCl在同温度、同质量分数的CaCl2和NaCl溶液中的溶解度相同
D.pH=6.5的CH3COOH与CH3COONa混合溶液中可能有c(Na+)=c(CH3COO-)
[iii].光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡:
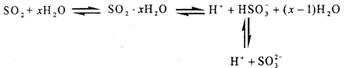 据此,下列判断中正确的是
据此,下列判断中正确的是
A.向该溶液中加入足量的酸都能放出SO2气体
B.该溶液中存在着SO2分子 C.该溶液中H+浓度是SO32-浓度的2倍
D.向该溶液中加入过量NaOH可得到Na2SO3 、NaHSO3和NaOH的混合溶液
[iv].在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下 (已知N2(g)+3H2(g)=2NH3(g)
⊿H= -92.4 kJ·mol-1):
(已知N2(g)+3H2(g)=2NH3(g)
⊿H= -92.4 kJ·mol-1):
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
|
NH3的浓度(mol·L-1) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
反应物转化率 |
α1 |
α2 |
α3 |
下列说法正确的是
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.α1+α3=1
[v].物质的量浓度相同的下列溶液中,既能跟NaOH溶液反应又能跟盐酸反应的pH最大的是
A.Na2CO3溶液 B.NH4HCO3溶液 C.NaHSO3溶液 D.NaHCO3溶液
[vi].常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如右图。下列说法正确的是
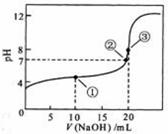 A.滴定过程中可能出现:
A.滴定过程中可能出现:
c(CH3COO-)>c(Na+)>c(CH3COOH)>c (H+)> c(OH-)
B.点①所示溶液中酸的中和率大于50%
C.点②是二者恰好中和点
D.点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)>c (H+)