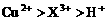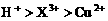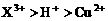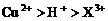0 31909 31917 31923 31927 31933 31935 31939 31945 31947 31953 31959 31963 31965 31969 31975 31977 31983 31987 31989 31993 31995 31999 32001 32003 32004 32005 32007 32008 32009 32011 32013 32017 32019 32023 32025 32029 32035 32037 32043 32047 32049 32053 32059 32065 32067 32073 32077 32079 32085 32089 32095 32103 447348
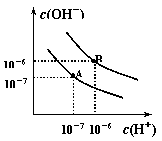 (9分).已知水在25℃和95℃时,其电离平衡曲线如右图所示:
(9分).已知水在25℃和95℃时,其电离平衡曲线如右图所示: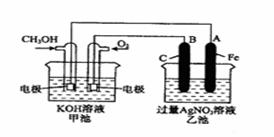
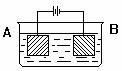
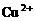 和
和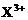 均为0.1 mol的溶液
均为0.1 mol的溶液 ,阴极析出金属的质量m(g)与溶液中通过电子的物质的量n(mol)关系如图,则离子的氧化能力由大到小排列正确的是
,阴极析出金属的质量m(g)与溶液中通过电子的物质的量n(mol)关系如图,则离子的氧化能力由大到小排列正确的是
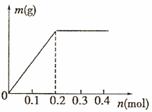 A.
A.