6.依据图形的有关化学方程式计算,如例6。
[典例精析]
例1:(南通市中考)密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
|
物 质 |
A |
B |
C |
D |
|
反应前质量/g |
19.7 |
8.7 |
31.6 |
O.4 |
|
反应后质量/g |
待测 |
17.4 |
0 |
3.6 |
下列说法正确的是( )
A.物质C一定是化合物,物质D可能是单质
B.反应后密闭容器中A的质量为19.7g
C.反应过程中,物质B与物质D变化的质量比为87∶36
D.若物质A与物质C的相对分子质量之比为197∶158,则反应中A与C的化学计量数之比为l∶2
解析 由题中所给的数据可知:C反应后质量没有了,说明是反应物,而B、D反应后质量都增加了,说明是生成物,C反应掉 31.6g,B、D共生成的质量只有 11.9g,说明A也生成物,且生成的质量为 19.7g,则该反应为分解反应,C一定是化合物,A、B、D可能是化合物,也可能是单质;然后由质量比、相对分子质量比求化学计量数比。
答案:AD
例2:(北京市中考)甲醇(CH3OH)是一种有毒、有酒的气味的可燃性液体。甲醇在氧气中不完全燃烧可发生如下反应:8CH3OH + nO2 mCO2 + 2CO + 16H2O。若反应生成3.6g水,请计算:
mCO2 + 2CO + 16H2O。若反应生成3.6g水,请计算:
(1) m值是
(2) 参加反应的氧气质量是多少克?(写出规范计算步骤)
解析 此题要求运用质量守恒定律,去确定化学计量数。质量守恒定律不仅体现在宏观上总质量相等、元素的质量相等,还体现在微观上原子个数相等。根据碳原子数反应前后相等,8=m+2 ,m=6 ;反应前后氧原子个数为8+2n=6×2+2+16 ,n=11 ,然后根据化学方程式,由生成3.6g水,求参加反应的氧气的质量。
答案:(1)6
(2) 8+2n=6×2+2+16 n=11
设参加反应的氧气质量为X
8CH3OH
+ 11O2 6CO2 + 2CO + 16H2O
6CO2 + 2CO + 16H2O
11×32 16×18
x 3.6g
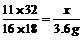
x=4.4g
答:参加反应的氧气为4.4g。
例3:(江西省中考)化学兴趣小组为了测定某钢铁厂生铁样品中铁的质量分数,在实验室将5.8g生铁样品放入烧杯中,加入50g稀硫酸恰好完全反应(杂质不参加反应),反应后称得烧杯中剩余物质的总质量为55.6g。求:
(1)产生氢气的质量是多少?
(2)该生铁样品中铁的质量分数?(结果保留一位小数)
解析 5.8g铁样品,55.6g稀硫酸均为混合物,其质量匀不能直接应用于化学方程式的计算。由铁样品和稀硫酸反应后剩余物质的总质量减少可得出生成氢气的质量,进而求出样品中铁的的质量及铁的质量分数。
答案:解:(1)依题意知生成氢气的质量:50g+5.8g-55.6g=0.2g
(2)设样品中铁的质量为x。
Fe+H2SO4 FeSO4+H2↑
FeSO4+H2↑
56 2
x 0.2g

答:(1)生成氢气0.2g (2)生铁样品中铁的质量分数为96.6%。
例4:(浙江衢州市中考)单晶硅是重要的半导体材料,是某市的拳头产品,该市某厂生产的单晶硅曾用于制造我国的第一颗人造卫生。在硅及相关产品的生产中排放的废水含有HCl。该厂化验员对本厂排放的废水中HCl的质量分数进行测定:将20mL废水(假定其密度为1g/cm3)样品置于锥形瓶中,用质量分数为1%的氢氧化钠溶液进行中和,共用去氢氧化钠溶液8g(假设废水中不含其他能与氢氧化钠溶液反应的物质)。
(1)计算该废水中含HCl的质量分数。
(2)该厂每天产生废水100t,若直接排放将对环境造成污染,必须进行无害化处理后才能进行排放,现准备用氢氧化钙粉末或质量分数为10%的氢氧化钠溶液进行中和。有关数据如下表所示:
|
物质 |
物质(或溶质)的相对分了质量 |
市场参考价元/吨 |
|
氢氧化钙粉末 |
74 |
200 |
|
10%的氢氧化钠溶液 |
40 |
100 |
你将选择 (写化学式)来中和废水中的HCl,请说明理由。
解析 该试题可运用性价比(即:用与等质量等质量分数的盐酸反应所消耗的氢氧化钙粉末和10%的氢氧化钠溶液的质量除以市场参考价)进行对比,比值越大经济上越合理。
答案:解:(1)设该厂排放的废水中含HCl的质量分数为x
NaOH + HCl = NaCl + H2O
40 36.5
8g×1% 20ml×1g/cm3×x
40∶36.5= 8g×1% ∶20ml×1g/cm3×x
X=0.365%
(2)Ca(OH)2 ,根据计算分别中和100吨废水,消耗氢氧化钙粉末0.37吨需要资金74元,消耗质量分数为10%氢氧化钠溶液4吨需要资金400元,从生产成本考虑选氢氧化钙粉末。
答:该废水中含HCl的质量分数0.365%,从生产成本考虑选氢氧化钙粉末。
例5:(镇江市中考)为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
|
|
第一次 |
第二次 |
第三次 |
|
所取合金的质量/g |
10 |
10 |
20 |
|
所用稀硫酸的质量/g |
50 |
80 |
50 |
|
生成氢气的质量/g |
0.2 |
0.2 |
0.2 |
(1) 试计算该铜锌合金中合金锌的质量。
(2) 从上表数据分析,当所取合金与所用稀硫酸的比为 时,表明合金中的锌与稀硫酸恰好完全反应。
(3)所用合金与稀硫酸恰好完全反应时所得溶液中溶质的质量分数。
解析 本题是根据化学方程式Zn+H2SO4=ZnSO4+H2↑进行计算,而准确分析题意,找准恰好完全反应时的数据是本题计算的关键。题目中三次实验制得的氢气的质量相等,说明三者实际消耗的硫酸和锌的质量相等,分析数据可知,第二次硫酸过量,第三次合金过量,故第一次所取合金与稀硫酸恰好完全反应。根据第一次实验产生氢气的质量和其所取用的稀硫酸与合金样品的质量,可求出合金中锌的质量以及恰好完全反应后所得溶液中溶质的质量分数。
答案: 解:(1)设合金中锌的质量为x,生成硫酸锌质量为y。
Zn+H2SO4 ZnSO4+H2↑
ZnSO4+H2↑
65 161 2
x y 0.2g
x:65=0.2g:2 x=6.5g
(2)1 :5
(3)y∶161=0.2g∶2 y=16.1g
所得溶液中ZnSO4的质量分数: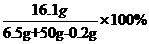 =28.6%
=28.6%
答:该铜锌合金中合金锌的质量为6.5g,当所取合金与所用稀硫酸的比为1∶5 时,合金中的锌与稀硫酸恰好完全反应,反应时所得溶液中溶质的质量分数为28.6%。
例6:(南通市中考)研究性学习:探究实验室中久置的NaOH的变质程度
<研究方案>先称取13.3g 的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量。从而进一步确定样品中NaOH的变质程度。
<解决问题>实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示。
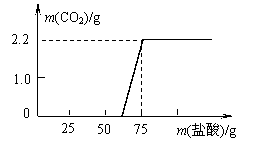 填写下表:(计算结果保留小数点后一位)
填写下表:(计算结果保留小数点后一位)
|
<继续探究>求实验过程中与NaOH反应所用盐酸的质量。
<发现问题>根据“与NaOH反应所用盐酸的质量”,对照图像,你发现了什么问题?
解析 该试题过程复杂,综合度高,难度大,首先要能正确分析出坐标图中横、纵坐标表示的量以及“三点一趋势”。其次,通过计算还要能发现NaOH被盐酸中和后继续滴加盐酸。为什么没有立即产生CO2气体等思维空间很大,使学生对已学的知识大胆提出质疑,打破思维定势发现和探究出新的问题。
|
答案:<解决问题>
<深入探究>m(NaOH)=13.3g-5.3g=8g
NaOH+HCl=NaCl+H2O
40 36.5
8g m(HCl)
m(HCl)= 8g×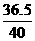 =7.3g
=7.3g
m[HCl(aq)]=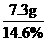 ×100%=50.0g
×100%=50.0g
<发现问题>NaOH被中和后,滴加盐酸,为什么没有立即产生CO2气体
[常见误区]
10.用好化学用语和溶解性表,对日后化学的学习是非常有帮助的。请按要求写出以下反应的化学方程式(所选的反应物在右表的范围内,
|
1) 一种酸和一种碱 ;
2) 一种酸和一种盐 ;
3) 一种碱和一种盐 ;
4) 一种盐和另一种盐 。
课题3 利用化学方程式的简单计算
[考点透视]