28.某学生进行研究性学习的课题为:用中和滴定法测定某烧碱的浓度。请回答他在主要操作过程中的有关问题:(15分,最后一空3分,其它各1分)
(1)配制待测溶液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所需的主要仪器除天平、药匙外,还有200mL容量瓶、胶头滴管、玻璃棒、烧杯;
(2)滴定:①盛装0.20mol/L的盐酸标准溶液应该用_酸 式滴定管,②滴定时,锥形瓶中加2--3滴酚酞作为指示剂,滴定过程中,一支手控制滴定管活塞,另一支手_摇动锥形瓶__,眼睛应注视_锥形瓶内颜色变化和液滴流流速,当_红色变为无色,半分钟内颜色不恢复时即为滴定终点;
③有关数据纪录如下:
|
滴定序号 |
待测溶液体积(单位:mL) |
所消耗盐酸体积(单位:mL) |
||
|
滴定前读数 |
滴定后读数 |
消耗盐酸体积 |
||
|
1 |
20.00 |
0.50 |
20.60 |
V(平)= _20.05__ |
|
2 |
20.00 |
6.00 |
26.00 |
(3)计算:测得NaOH溶液的浓度为 _0.20 _mol/L,烧碱样品的纯度为 94.12% _____。
(4)若该学生测定值偏大了,则该同学引起测定误差的可能原因是__A B D___,
A.酸式滴定管用水洗后,未用标准酸液润洗
B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C.锥形瓶用蒸馏水洗后,未用碱液洗
D.酸式滴定管起始读数俯视,滴定后读数仰视
E.在滴定过程中向锥形瓶中添加少量蒸馏水
F.取待测液时,碱式滴定管未用碱液洗
G.当指示剂局部变色时,停止滴定
(15分,毎空2分)三农问题是政府和社会关注的问题,化肥是土地的营养品。某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
① 配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
② 每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③ 加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液煮沸约1分钟,冷却至常温;
④ ……………………;
⑤ 重复②③④步操作1-2次;
⑥ 记录整理实验所得数据,计算该化肥中氮元素的质量分数。
请回答下列问题:
(1)写出步骤④中的实验内容 以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V(mL) ,写出实验步骤④中的离子方程式: OH-+H+ =H2O 。(4分,各2分)
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是 A C (填代号)(2分)
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是 减小误差,提高实验结果的准确度 。(2分)
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液,从节约化学药品的角度出发,最好应选用的容量瓶规格分别为 C (填字母选项)。(2分)
A.50mL,50mL B. 150mL,100mL C. 100mL,150mL D. 250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式
为 (30×10-3×1-Vx×10-3×1)×14/1 ×100% 。(不需要化简)(2分)
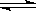 2Z(g),当其它条件不变减小压强时,对反应产生的影响是( )
2Z(g),当其它条件不变减小压强时,对反应产生的影响是( ) A.缺铁
会引起贫血 B.喝加钙奶
补充铁元素
A.缺铁
会引起贫血 B.喝加钙奶
补充铁元素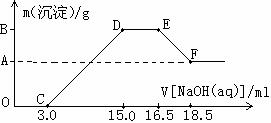 (1)应后的溶液中加入NaOH的溶液没有立即出现沉淀的原因
(1)应后的溶液中加入NaOH的溶液没有立即出现沉淀的原因