25.(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) 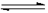 CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:
(1)该反应的化学平衡常数K = 。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO) =0.01mol/L,
c(H2O) =0.03mol/L, c(CO2) =0.01mol/L, c(H2) =0.05mol/L ,则反应开始时,H2O的消耗速率比生成速率 (填“大”“小”或“不能确定”)
(4) 830℃,在1L的固定容器的密闭容器中放入2molCO2和1molH2,平衡后H2的转化率为 .
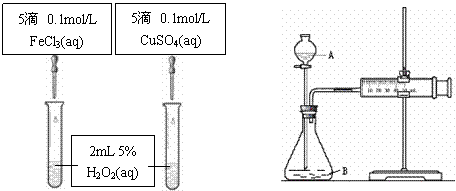 有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进?
有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进?
 C(g)
+D(g) 过程中的能量变化如图所示,回答下列问题:
C(g)
+D(g) 过程中的能量变化如图所示,回答下列问题: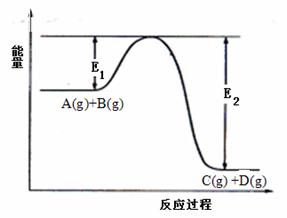 (1)
该反应是________________反应(填“吸热”“放热”);
(1)
该反应是________________反应(填“吸热”“放热”);  H2(g)+CO(g)在密闭容器中进行,其他条件不变,改变下列条件能加快正反应速率的是
A.将容器体积缩小一半使压强增大 B.体积不变充入H2O(g)使压强增大
C.体积不变充入He气使压强增大 D.压强不变充入N2使体积增大
E.体积不变升高温度使压强增大 F.增加C的投入量
H2(g)+CO(g)在密闭容器中进行,其他条件不变,改变下列条件能加快正反应速率的是
A.将容器体积缩小一半使压强增大 B.体积不变充入H2O(g)使压强增大
C.体积不变充入He气使压强增大 D.压强不变充入N2使体积增大
E.体积不变升高温度使压强增大 F.增加C的投入量 cC(g)+d
D(g),取a molA和b molB置于V L容器中,
cC(g)+d
D(g),取a molA和b molB置于V L容器中,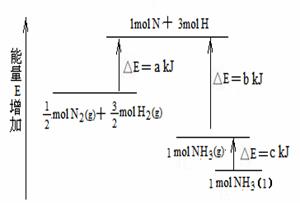 A.N2(g)+3H2(g) = 2NH3(l);
A.N2(g)+3H2(g) = 2NH3(l);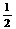 N2(g)+
N2(g)+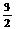 H2(g)
= NH3(l) ;
H2(g)
= NH3(l) ;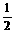 N2(g)+
N2(g)+