21、(8分)在一定体积的密闭容器中,进行如下化学反应:
|
 CO2(g)+H2(g),
CO2(g)+H2(g),
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应为 反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
(4)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积,平衡 移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
(5)若830℃时,向容器中充入1 molCO、5 molH2O,反应达到平衡后,CO的转化率为
18、( 11分)某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250ml溶液,需要的主要仪器有 。
(2)滴定
① 用 量取10.00ml待测液。
② 用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,加入几滴酚酞,边滴边摇动锥形瓶,眼睛注视 ,直到 时停止滴定
(3)数据处理
|
实验次数编号 |
盐酸溶液体积 V(ml) |
氢氧化钠溶液体积 V(ml) |
|
1 |
19.90 |
10.00 |
|
2 |
20.10 |
10.00 |
|
3 |
22.00 |
10.00 |
|
4 |
20.00 |
10.00 |
根据上述各数据,选取合适的三组,计算待测烧碱溶液的浓度为 ,烧碱的纯度为 。
(4)下列操作,会导致实验结果偏低是 (填序号)。
①碱式滴定管用蒸馏水洗净后没有用待测液润洗
②终点读数时俯视(滴定前读数准确)
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④酸式滴定管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗
⑥振荡时锥形瓶中液滴飞溅出来
 25、(10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
25、(10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: CH3OH(g)
CH3OH(g)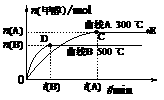
 2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题: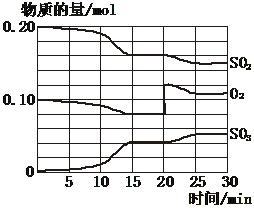
 2SO3(g)
2SO3(g)